Với giải Câu hỏi trang 37 SBT Hoá học10 Kết nối tri thức Bài 14: Ôn tập chương 3 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
SBT Hoá học 10 Kết nối tri thức trang 37 Bài 14: Ôn tập chương 3
Bài 14.7 trang 37 SBT Hóa học 10: Nguyên tố X ở nhóm IA và nguyên tố Y ở nhóm VIIA của bảng tuần hoàn X và Y có thể tạo thành hợp chất R. Liên kết giữa các nguyên tử trong R thuộc loại liên kết nào sau đây?
A. Ion. B. Cộng hoá trị phân cực.
C. Cộng hoá trị không phân cực. D. Hydrogen.
Phương pháp giải:
Dựa vào:
- Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học
- Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình
Lời giải:
- Đáp án: A
- Giải thích: nguyên tố nhóm IA là kim loại điển hình, nguyên tố nhóm VIIA là phi kim điển hình
Bài 14.8 trang 37 SBT Hóa học 10: X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là
A. (X, Y); (X, Z) và (Y, Z). B. (X, Z); (Y, Z) và (X, Y).
C. (X, Y); (Y, Z) và (X, Z). D. (Z, Y); (Y, X) và (X, Z).
Phương pháp giải:
Dựa vào:
- Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học
- Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình
Lời giải:
- Cấu hình electron của nguyên tử X là: 1s22s22p4
=> X thuộc nhóm VIA, chu kì 2 " X là oxygen (O)
- Cấu hình electron của nguyên tử Y là: 1s22s22p63s23p64s1
=> Y thuộc nhóm IA, chu kì 4 " Y là potassium (K)
- Cấu hình electron của nguyên tử Z là: 1s22s22p63s23p4
=> Z thuộc nhóm VIA, chu kì 3 " Z là sulfur (S)
=> Cặp nguyên tố tạo liên kết ion là X, Y và Y, Z
=> Cặp nguyên tố tạo liên kết cộng hóa trị là X, Z
=> Đáp án: C
A. 2. B. 4. C. 5. D. 3.
Phương pháp giải:
Dựa vào hiệu độ âm điện:
|
Hiệu độ âm điện (Δχ) |
Loại liên kết |
|
0≤Δχ<0,4 |
Cộng hóa trị không phân cực |
|
0,4≤Δχ<1,7 |
Cộng hóa trị phân cực |
|
Δχ≥1,7 |
Ion |
- Các phân tử được cấu tạo từ cùng 1 nguyên tố " chỉ chứa liên kết cộng hóa trị không phân cực
Lời giải:
- Đáp án: A (N2 và H2)
Bài 14.10 trang 37 SBT Hóa học 10: Cho các chất sau:
(1) H2S; (2) SO2; (3) NaCl; (4) CaO;
(5) NH3; (6) HBг; (7) CO2; (8) K2S.
Dãy nào sau đây gồm các chất có liên kết cộng hoá trị?
A. (1); (2); (3); (4); (7). B. (1); (2); (5); (6); (7).
C. (1); (3); (5); (6); (7). D. (1); (2); (5); (7); (8).
Phương pháp giải:
Dựa vào
- Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học
- Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình
Lời giải:
- Đáp án: B
- Giải thích: các chất (1); (2); (5); (6); (7) chỉ gồm các phi kim " chỉ chứa liên kết cộng hóa trị
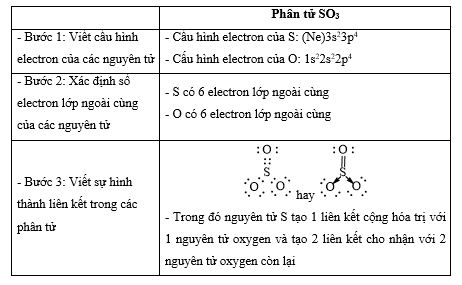
Bài 14.11 trang 37 SBT Hóa học 10: Dùng công thức Lewis để biểu diễn phân tử SO3 sao cho phù hợp với quy tắc octet. Chỉ rõ các liên kết trong phân tử thuộc loại liên kết nào.
Phương pháp giải:
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
Lời giải:
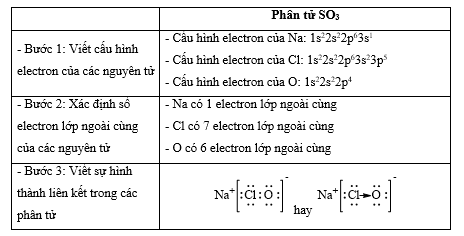
Bài 14.12 trang 37 SBT Hóa học 10: Hợp chất NaClO là thành phần của chất tẩy rửa, sát trùng có tên gọi là “Nước Javen”. Áp dụng quy tắc octet để giải thích sự hình thành các liên kết trong hợp chất đó.
Phương pháp giải:
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
Lời giải:
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 14.3 trang 36 SBT Hóa học 10: Liên kết ion khác với liên kết cộng hoá trị ở điểm nào sau đây?...
Bài 14.4 trang 36 SBT Hóa học 10: Cho chất hữu cơ A có công thức cấu tạo sau...
Bài 14.6 trang 36 SBT Hóa học 10: Cho hai chất hữu cơ X và Y có công thức cấu tạo sau...
Bài 14.10 trang 37 SBT Hóa học 10: Cho các chất sau...
Bài 14.13 trang 38 SBT Hóa học 10: Tính số liên kết σ và liên kết π trong các phân tử sau...
Bài 14.15 trang 38 SBT Hóa học 10: Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.