Với giải Câu hỏi trang 38 SBT Hoá học10 Kết nối tri thức Bài 14: Ôn tập chương 3 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
SBT Hoá học 10 Kết nối tri thức trang 38 Bài 14: Ôn tập chương 3
Bài 14.13 trang 38 SBT Hóa học 10: Tính số liên kết σ và liên kết π trong các phân tử sau:
a) C2H4; b) C2H2; c) HCN; d) HCOOH.
Phương pháp giải:
Dựa vào công thức cấu tạo của các phân tử và
- Các liên kết cộng hóa trị đơn đều là liên kết σ
- 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π
- 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π
Lời giải:
a) Công thức cấu tạo của C2H4 là:
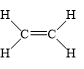
Phân tử C2H4 có: 5 liên kết σ và 1 liên kết π
b) Công thức cấu tạo của C2H2 là:
Phân tử C2H2 có: 3 liên kết σ và 2 liên kết π
c) Công thức cấu tạo của HCN là:
Phân tử HCN có: 2 liên kết σ và 2 liên kết π
d) Công thức cấu tạo của HCOOH là:
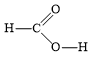
Phân tử HCOOH có: 4 liên kết σ và 1 liên kết π
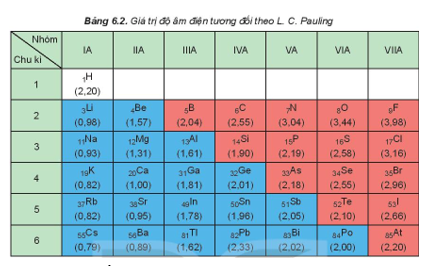
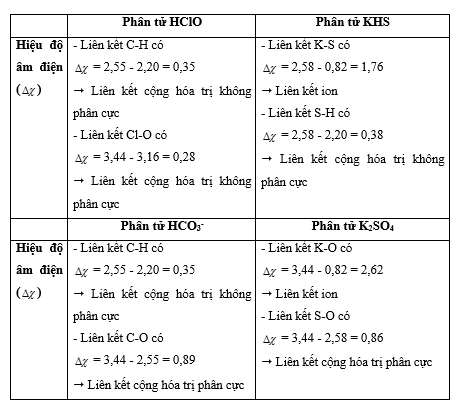
Bài 14.14 trang 38 SBT Hóa học 10: Dựa vào giá trị của độ âm điện ở Bảng 6.2 trong sách giáo khoa Hóa học 10, hãy nêu bản chất liên kết trong các phân tử và ion sau: HClO, KHS, HCO3-, K2SO4.
Phương pháp giải:
Dựa vào hiệu độ âm điện:
|
Hiệu độ âm điện (Δχ) |
Loại liên kết |
|
0≤Δχ<0,4 |
Cộng hóa trị không phân cực |
|
0,4≤Δχ<1,7 |
Cộng hóa trị phân cực |
|
Δχ≥1,7 |
Ion |
Lời giải:
Bài 14.15 trang 38 SBT Hóa học 10: Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau:
HF (19,5); HCl (-85), HBr (-66); HI (-35).
a) Nêu xu hướng biến đổi nhiệt độ sôi trong dãy chất trên.
b) Đề xuất lí do nhiệt độ sôi của HF không theo xu hướng này.
Phương pháp giải:
Dựa vào ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ sôi và nhiệt độ nóng chảy của các chất
- Các chất có liên kết hydrogen đều có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các chất không có liên kết hydrogen
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải:
a) Xu hướng biến đổi nhiệt độ sôi: HF có nhiệt độ sôi cao bất thường, sau đó nhiệt độ sôi tăng dần từ HCl đến HI
b) Giải thích: HF có liên kết hydrogen => nhiệt độ sôi cao nhất
a) Tính số khối của A, B.
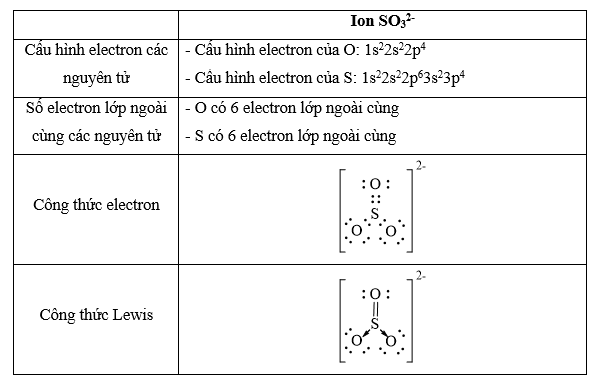
b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet.
Phương pháp giải:
- Xác định số electron của mỗi nguyên tử A và B
- Các bước thực hiện viết cấu tạo Lewis:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
Lời giải:
a) - Gọi số hạt proton, electron và neutron trong nguyên tử A lần lượt là p1, e1, n1
- Có số hạt proton, electron và neutron trong B lần lượt là p2, e2, n2
- Có tổng số electron trong anion AB32- là 42
=> p1 + 3p2 + 2 = 42 => 3p2=40−p1 " p2<403=13,333
- Do trong các hạt nhân A cũng như B có số proton bằng số neutron
=> p2 = 8 => p1 = 16 => A là nguyên tố sulfur (S) và B là nguyên tố oxygen (O)
- Số khối của S = 16 + 16 = 32
- Số khối của O = 8 + 8 = 16
b)
Bài 14.17 trang 38 SBT Hóa học 10: Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa,... X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Phương pháp giải:
- Nguyên tố s có 7 electron s => cấu hình electron là: 1s22s22p63s23p64s1
-> Đây là nguyên tố potassium (K)
- Nguyên tố p có 11 electron p -> cấu hình electron là: 1s22s22p63s23p5
-> Đây là nguyên tố chlorine (Cl)
- Nguyên tố p có 4 electron p -> cấu hình electron là: 1s22s22p4
-> Đây là nguyên tố oxygen (O)
=> Công thức tổng quát của X có dạng KxClyOz
- Có => z = 3
- Có x.39 + y.35,5 + 3.16 = 122,5 -> x = y = 1
=> Công thức phân tử của X là KClO3
Lời giải:
- Nguyên tố s có 7 electron s => cấu hình electron là: 1s22s22p63s23p64s1
-> Đây là nguyên tố potassium (K)
- Nguyên tố p có 11 electron p -> cấu hình electron là: 1s22s22p63s23p5
-> Đây là nguyên tố chlorine (Cl)
- Nguyên tố p có 4 electron p -> cấu hình electron là: 1s22s22p4
-> Đây là nguyên tố oxygen (O)
=> Công thức tổng quát của X có dạng KxClyOz
- Có => z = 3
- Có x.39 + y.35,5 + 3.16 = 122,5 -> x = y = 1
=> Công thức phân tử của X là KClO3
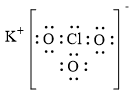
b)- Công thức Lewis của KClO3 là:
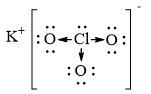
-> Trong đó ion K+ liên kết với ion ClO3- bằng liên kết ion, các liên kết giữa Cl - O là liên kết cộng hóa trị
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 14.3 trang 36 SBT Hóa học 10: Liên kết ion khác với liên kết cộng hoá trị ở điểm nào sau đây?...
Bài 14.4 trang 36 SBT Hóa học 10: Cho chất hữu cơ A có công thức cấu tạo sau...
Bài 14.6 trang 36 SBT Hóa học 10: Cho hai chất hữu cơ X và Y có công thức cấu tạo sau...
Bài 14.10 trang 37 SBT Hóa học 10: Cho các chất sau...
Bài 14.13 trang 38 SBT Hóa học 10: Tính số liên kết σ và liên kết π trong các phân tử sau...
Bài 14.15 trang 38 SBT Hóa học 10: Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.