Với giải Câu hỏi trang 42 SBT Hoá học10 Kết nối tri thức Bài 15: Phản ứng oxi hóa - khử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 42 Bài 15: Phản ứng oxi hóa - khử
Bài 15.22 trang 42 SBT Hóa học 10: Khi đốt hoá lỏng thường gọi là gas, có thành phần gồm propane (C3H8) và butane (C4H10). Xét phản ứng đốt cháy butane khi đun bếp gas:
C4H10 + O2 ->CO2 + H2O.
a) Xác định các nguyên tử có sự thay đổi số oxi hoá. Chỉ rõ chất oxi hoá, chất khử.
b) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron
Phương pháp giải:
Dựa vào
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
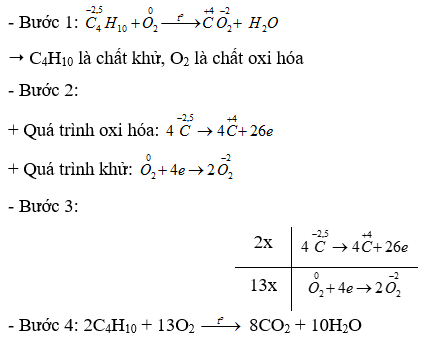
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron Chi rõ chất oxi hóa, chất khử.
b) Tính thể tích dung dịch KMnO4 0,02 M để phản ứng vừa đủ với 20 mL dung dịch FeSO4 0,10 M.
Phương pháp giải:
Dựa vào
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
a) - Bước 1:
=> FeSO4 là chất khử, KMnO4 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa:
+ Quá trình khử:
- Bước 3:
|
5x |
|
|
2x |
|
- Bước 4: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
b) mol
-> Theo phản ứng ta có: mol
-> (L) = 20 (mL)
Bài 15.24 trang 42 SBT Hóa học 10: Cho 2,34 g kim loại M (hoá trị n) tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thu được 3,2227 L khí SO2 (điều kiện chuẩn). Xác định kim loại M.
Phương pháp giải:
- Viết quá trình cho nhận electron
- Áp dụng định luật bảo toàn electron:
- Kẻ bảng xét hóa trị của M từ 1 đến 3
Lời giải:
- Ta có các quá trình cho nhận e như sau:
- Có mol => n e nhận = 0,13.2 = 0,26 mol = n e cho
=> nM = => MM =
- Ta có bảng giá trị:
|
n |
1 |
2 |
3 |
|
M |
9 (loại) |
18 (loại) |
27 (t/m) |
=> Vậy kim loại M là aluminium (Al)
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15.2 trang 39 SBT Hóa học 10: Trong hợp chất SO3, số oxi hoá của sulfur (lưu huỳnh) là...
Bài 15.5 trang 39 SBT Hóa học 10: Chromium có số oxi hóa +2 trong hợp chất nào sau đây?..
Bài 15.6 trang 39 SBT Hóa học 10: Phản ứng oxi hoá - khử là phản ứng có sự nhường và nhận...
Bài 15.8 trang 39 SBT Hóa học 10: Trong phản ứng oxi hoá - khử, chất oxi hoá là chất...
Bài 15.10 trang 40 SBT Hóa học 10: Phản ứng nào sau đây là phản ứng oxi hoá - khử?...
Bài 15.13 trang 40 SBT Hóa học 10: Cho các phân tử có công thức cấu tạo sau...
Bài 15.14 trang 40 SBT Hóa học 10: Carbon đóng vai trò chất oxi hoá ở phản ứng nào sau đây?...
Bài 15.15 trang 40 SBT Hóa học 10: Thực hiện các phản ứng hoá học sau...
Bài 15.18 trang 41 SBT Hóa học 10: Cho các phản ứng hoá học sau...
Bài 15.20 trang 41 SBT Hóa học 10: Xét phản ứng sản xuất Cl2, trong công nghiệp...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.