Với giải Câu hỏi trang 44 SBT Hoá học10 Kết nối tri thức Bài 16: Ôn tập chương 4 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 44 Bài 16: Ôn tập chương 4
Bài 16.12 trang 44 SBT Hóa học 10: Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02 M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O " H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Phương pháp giải:
Dựa vào
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
a) - Bước 1:
=> SO2 là chất khử, KMnO4 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa:
+ Quá trình khử:
- Bước 3:
|
5x |
|
|
2x |
|
- Bước 4: 5SO2 + 2KMnO4 + 2H2O " 2H2SO4 + K2SO4 + 2MnSO4
b) mol
=> Theo phản ứng ta có: mol
=> (L) = 123,95 (mL)
Bài 16.13 trang 44 SBT Hóa học 10: Thực hiện các phản ứng sau:
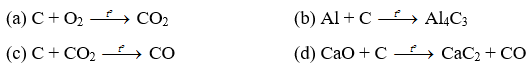
Xác định phản ứng trong đó carbon vừa đóng vai trò chất oxi hóa, vừa đóng vai trò khử. Lập phương trình hoá học của phản ứng đó theo phương pháp thăng bằng electron.
Phương pháp giải:
Xác định số oxi hóa của các nguyên tử carbon trong các phản ứng " Phản ứng nào số oxi hóa của carbon vừa tăng vừa giảm chứng tỏ trong phản ứng đó carbon đóng vai trò vừa là chất khử và vừa là chất oxi hóa
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
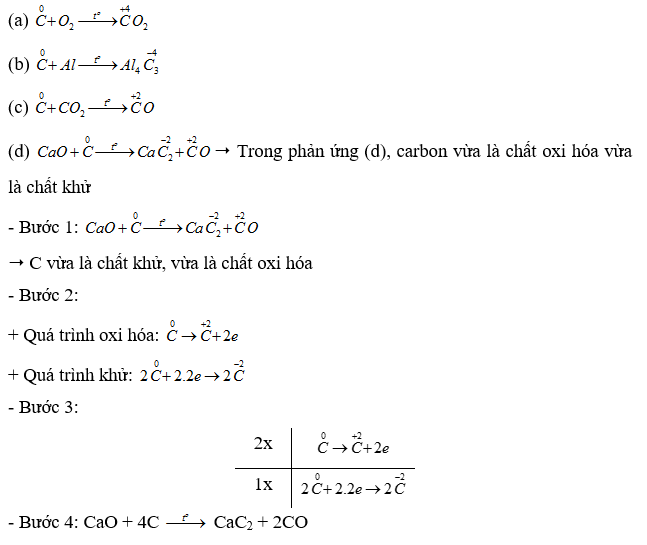
Bài 16.14 trang 44 SBT Hóa học 10: Đốt cháy hoàn toàn 2,52 g hỗn hợp gồm Mg và Al cần vừa đủ 2,479 L hỗn hợp khí X gồm O2 và Cl2 ở điều kiện chuẩn, thu được 8,84 g chất rắn.
a) Tính phần trăm thể tích mỗi khí trong X
b) Xác định số mol electron các chất khử cho và số mol electron các chất oxi hóa nhận trong quá trình phản ứng.
Phương pháp giải:
Dựa vào
a) - Định luật bảo toàn khối lượng => khối lượng hỗn hợp khí X
- Lập hệ hai phương trình tìm ra số mol từng chất trong X => Tính % thể tích = % số mol mỗi khí trong X
b) - Viết các quá trình cho và nhận electron
- Đặt số mol các chất cho và nhận electron vào các quá trình cho và nhận electron
- Áp dụng định luật bảo toàn electron:
Lời giải:
a) - Bảo toàn khối lượng cho phản ứng ta có:
=> mX = 8,84 - 2,52 = 6,32 gam
- Đặt mol; mol
- Khối lượng hỗn hợp X là: (gam) (1)
- Tổng số mol hỗn hợp X là: (mol) (2)
- Từ (1) và (2) " x = 0,02 và y = 0,08
" và
b)
- Có (mol)
Bài 16.15 trang 44 SBT Hóa học 10: Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid. Xét phản ứng đốt cháy:
![]()
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Tính thể tích không khí (chứa 21% thể tích oxygen ở điều kiện chuẩn) cần dùng để đốt cháy hoàn toàn 2,4 tấn FeS2 trong quặng pyrite
Phương pháp giải:
Dựa vào
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=>Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
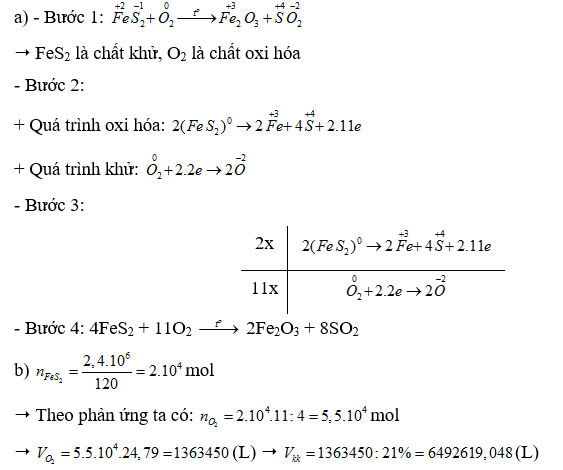
Bài 16.1 trang 42 SBT Hóa học 10: Trong phản ứng oxi hoá - khử, chất nhường electron được gọi là...
Bài 16.2 trang 42 SBT Hóa học 10: Iron có số oxi hoá +2 trong hợp chất nào sau đây?...
Bài 16.4 trang 43 SBT Hóa học 10: Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng...
Bài 16.5 trang 43 SBT Hóa học 10: Xét phản ứng điều chế H2 trong phòng thí nghiệm...
Bài 16.7 trang 43 SBT Hóa học 10: Nguyên tử sulfur chỉ thể hiện tính khử trong chất nào sau đây?..
Bài 16.13 trang 44 SBT Hóa học 10: Thực hiện các phản ứng sau...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.