Với giải SGK KHTN 8 Kết nối tri thức trang 25 chi tiết trong Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập KHTN 8. Mời các bạn đón xem:
Giải KHTN 8 trang 25 (Kết nối tri thức)
Câu hỏi trang 25 KHTN 8: Carbon tác dụng với oxygen theo sơ đồ Hình 5.1:
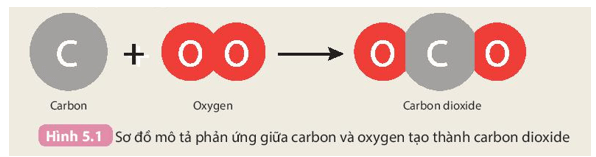
Giải thích tại sao khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen.
Trả lời:
Khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen do trong phản ứng hoá học chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hoá học vẫn giữ nguyên.
Trả lời:
Xỉ than nhẹ hơn than tổ ong. Do sau khi đốt cháy than tổ ong (thành phần chính là carbon) sản phầm thu được ngoài xỉ than còn có các khí (thành phần chứa nguyên tố carbon) là carbon monoxide; carbon dioxide.
Calcium oxide + Carbon dioxide → Calcium carbonate
Calcium oxide + Nước → Calcium hydroxide
Khi làm thí nghiệm, một học sinh quên đậy nắp lọ đựng vôi sống (thành phần chính là CaO), sau một thời gian thì khối lượng của lọ sẽ thay đổi như thế nào?
Trả lời:
Sau một thời gian mở nắp lọ, vôi sống sẽ phản ứng với một số chất có mặt trong không khí như carbon dioxide, hơi nước … tạo thành các chất mới có khối lượng lớn hơn khối lượng vôi sống ban đầu. Do đó khối lượng của lọ sẽ tăng lên.
Hoạt động trang 26 KHTN 8: Lập phương trình hoá học của các phản ứng sau:
a) Fe + O2 − − → Fe3O4
b) Al + HCl − − → AlCl3 + H2
c) Al2(SO4)3 + NaOH − − → Al(OH)3 + Na2SO4
d) CaCO3 + HCl − − → CaCl2 + CO2 + H2O
Trả lời:
a) Fe + O2 − − → Fe3O4
Số nguyên tử Fe và O ở hai vế không bằng nhau, nhưng O có số nguyên tử nhiều hơn nên ta bắt đầu từ nguyên tố này trước. Do O2 có 2 nguyên tử O còn Fe3O4 có 4 nguyên tử O nên ta đặt hệ số 2 trước O2; để cân bằng tiếp số nguyên tử Fe ta đặt hệ số 3 vào trước Fe ở vế trái. Phương trình hoá học của phản ứng hoàn thiện như sau:
3Fe + 2O2 → Fe3O4.
b) Al + HCl − − → AlCl3 + H2
Trước phản ứng có 1 nguyên tử H và 1 nguyên tử Cl trong phân tử HCl; sau phản ứng có 3 nguyên tử Cl trong AlCl3; 2 nguyên tử H trong phân tử H2, do đó ta lấy bội chung nhỏ nhất của 3 và 2 là 6, đặt trước HCl, được:
Al + 6HCl − − → AlCl3 + H2
Để cân bằng số nguyên tử H ta đặt hệ số 3 trước H2; để cân bằng số nguyên tử Cl ta đặt hệ số 2 trước AlCl3, được:
Al + 6HCl − − → 2AlCl3 + 3H2
Cuối cùng để cân bằng số nguyên tử Al ta thêm hệ số 2 trước Al ở vế trái. Phương trình hoá học của phản ứng được hoàn thiện như sau:
2Al + 6HCl → 2AlCl3 + 3H2
c) Al2(SO4)3 + NaOH − − → Al(OH)3 + Na2SO4
Trước tiên ta cân bằng nhóm (SO4) bằng cách đặt hệ số 3 vào trước Na2SO4:
Al2(SO4)3 + NaOH − − → Al(OH)3 + 3Na2SO4
Để cân bằng tiếp số nguyên tử Na ta thêm hệ số 6 vào trước NaOH.
Al2(SO4)3 + 6NaOH − − → Al(OH)3 + 3Na2SO4
Cuối cùng thêm hệ số 2 trước Al(OH)3 để đảm bảo cân bằng số nguyên tử Al và nhóm (OH), khi đó phương trình hoá học được thiết lập:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
d) CaCO3 + HCl − − → CaCl2 + CO2 + H2O
Ta thấy trước phản ứng có 1 nguyên tử H; 1 nguyên tử Cl trong phân tử HCl; Sau phản ứng có 2 nguyên tử Cl trong CaCl2; 2 nguyên tử H trong H2O. Để cân bằng số nguyên tử H và Cl ta thêm hệ số 2 trước HCl.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Kiểm tra lại thấy các nguyên tử đã được cân bằng, phương trình hoá học được hoàn thiện.
Xem thêm các bài giải KHTN 8 Kết nối tri thức hay, chi tiết khác:
Câu hỏi trang 25 KHTN 8: Carbon tác dụng với oxygen theo sơ đồ Hình 5.1:
Hoạt động trang 26 KHTN 8: Lập phương trình hoá học của các phản ứng sau:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.