Toptailieu.vn xin giới thiệu Lý thuyết KHTH 8 (Kết nối tri thức) Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết KHTH 8 (Kết nối tri thức) Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Bài giảng Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
A. Kiến thức trọng tâm KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
I. Định luật bảo toàn khối lượng
1. Nội dung định luật bảo toàn khối lượng
- Nội dung định luật: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
- Thí nghiệm: Chuẩn bị dung dịch barium chloride, sodium sulfate, cản điện tử, cốc thuỷ tinh. Trên mặt cân đặt 2 cốc, ghi tổng khối lượng 2 cốc. Đổ cốc (1) vào cốc (2), quan sát thấy có một chất rắn màu trắng xuất hiện ở cốc (2). Đặt 2 cái trở lại cuặt cầu. So sánh tổng khối lượng của các chất trước phản ứng với tổng khối lượng các chất sau phản ứng.
- Áp dụng định luật bảo toàn khối lượng:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
- Biết khối lượng Barium chloride và Sodium sulfate đã phản ứng lần lượt là 20,8 gam và 14,2 gam, khối lượng của Barium sulfate tạo thành là 23,3 gam, ta sẽ xác định được khối lượng của Sodium chloride tạo thành là: 20,8 + 14,2 - 23,3 = 11,7(g).
- Tổng quát: Nếu trong phản ứng có n chất, khi biết khối lượng đã tham gia và tạo thành của (n - 1) chất, ta sẽ xác định được khối lượng của chất còn lại.
- Thành phần chính của than tổ ong là carbon. Sau khi đốt cháy than tổ ong, ta thu được xỉ than (tạp chất không cháy). Vì vậy, khối lượng của xỉ than sẽ nhẹ hơn khối lượng của than tổ ong ban đầu.
- Sau một thời gian không đậy nắp lọ đựng với sống (CaO), khối lượng của hỗn hợp sẽ tăng lên do CaO hút ẩm trong không khí tạo thành Ca(OH)2. Do đó, khối lượng của hỗn hợp sẽ tăng lên.
II. Phương trình hóa học
1. Lập Phương trình hóa học
- Phương trình hoá học của phản ứng giữa khí hydrogen và khí oxygen là:
2H2 + O2 → 2H2O
- Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. Sau khi cân bằng, tổng số nguyên tử của mỗi nguyên tố ở hai vẽ của sơ đồ phản ứng bằng nhau, ta được PTHH.
- Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
Al + O2 Al2O3
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế. Với trường hợp này, ta cần đặt hệ số 2 trước Al2O3 và hệ số 3 trước O2:
4Al + 3O2 → 2Al2O3
Bước 3: Viết phương trình hoá học của phản ứng:
4Al + 3O2 → 2Al2O3
Lưu ý:
- Hệ số viết ngang với kí hiệu của các chất.
- Không thay đổi các chỉ số trong các công thức hoá học đã viết đúng.
- Nếu trong công thức hoá học, các chất ở 2 vế có những nhóm nguyên tử giống nhau, ta coi nhóm nguyên tử này như một "nguyên tố để cân bằng".
2. Ý nghĩa của phương trình hoá học
Phương trình hoá học thể hiện tỉ lệ số mol giữa các chất tham gia và sản phẩm trong một phản ứng hoá học. Từ đó, ta có thể xác định được tỉ lệ hệ số của các chất trong phản ứng và tỉ lệ số mol, cũng như tỉ lệ khối lượng của chúng. Ví dụ: Trong phản ứng 4Al + 3O2 --> 2Al2O3, ta biết được rằng để phản ứng hoàn toàn, cần sử dụng 4 mol nhôm với 3 mol oxi, tạo ra 2 mol nhôm oxit. Từ đó, ta có thể tính toán được tỉ lệ số mol và khối lượng giữa các chất trong phản ứng.
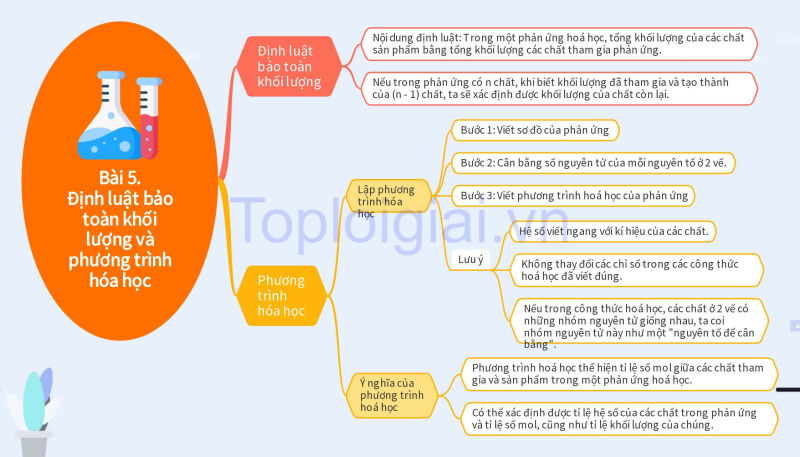
Sơ đồ tư duy KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
B. Bài tập KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Đang cập nhật
Xem thêm các bài lý thuyết Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Bài 6: Tính theo phương trình hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.