Với giải Hoạt động trang 50 KHTN 8 Kết nối tri thức chi tiết trong Bài 11: Muối giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập KHTN 8. Mời các bạn đón xem:
Tìm hiểu tính chất hoá học của muối Chuẩn bị: Các dung dịch: H2SO4 loãng, NaOH loãng
Hoạt động trang 50 KHTN 8: Tìm hiểu tính chất hoá học của muối
Chuẩn bị: Các dung dịch: H2SO4 loãng, NaOH loãng, Na2SO4, CuSO4; 4 ống nghiệm: ống (1) chứa 1 đinh sắt đã được làm sạch, ống (2) và (3) mỗi ống nghiệm chứa khoảng 1 mL dung dịch BaCl2, ống (4) chứa khoảng 1 mL dung dịch CuSO4.
Tiến hành: ống (1) cho khoảng 2 mL dung dịch CuSO4; ống (2) cho khoảng 1 mL dung dịch H2SO4; ống (3) cho khoảng 1 mL dung dịch Na2SO4; ống (4) cho khoảng 1 mL dung dịch NaOH
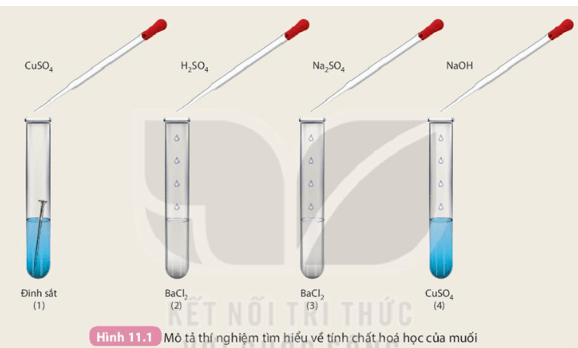
Quan sát hiện tượng xảy ra ở mỗi ống nghiệm và thực hiện yêu cầu:
1. Viết phương trình hoá học, giải thích hiện tượng xảy ra.
2. Thảo luận nhóm rút ra kết luận về tính chất hoá học của muối.
Trả lời:
1.
+ Ống nghiệm 1:
Hiện tượng: Đinh sắt tan dần, có lớp kim loại màu đỏ bám ngoài đinh sắt; Dung dịch trong ống nghiệm nhạt màu dần.
Phương trình hoá học: Fe + CuSO4 → FeSO4 + Cu.
+ Ống nghiệm 2:
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: BaCl2 + H2SO4 → BaSO4 + 2HCl.
+ Ống nghiệm 3:
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
+ Ống nghiệm 4:
Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4.
2. Một số tính chất hoá học của muối:
- Dung dịch muối có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới. Ví dụ: Fe + CuSO4 → FeSO4 + Cu.
- Muối có thể tác dụng với một số dung dịch acid tạo thành muối mới và acid mới. Sản phẩm của phản ứng tạo thành có ít nhất một chất là chất khí/ chất ít tan/ không tan … Ví dụ: BaCl2 + H2SO4 → BaSO4 + 2HCl.
- Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khí/ chất ít tan/ không tan … Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4.
- Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó có ít nhất một muối không tan hoặc ít tan. Ví dụ:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Xem thêm các bài giải KHTN 8 Kết nối tri thức hay, chi tiết khác:
Hoạt động trang 48 KHTN 8: Tìm hiểu về các phản ứng tạo muối
Câu hỏi 2 trang 49 KHTN 8: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Câu hỏi 3 trang 49 KHTN 8: Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
Hoạt động trang 50 KHTN 8: Tìm hiểu tính chất hoá học của muối
Câu hỏi trang 52 KHTN 8: Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.