Với giải SGK KHTN 8 Kết nối tri thức trang 49 chi tiết trong Bài 11: Muối giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập KHTN 8. Mời các bạn đón xem:
Giải KHTN 8 trang 49 (Kết nối tri thức)
Trả lời:
Potassium sulfate: K2SO4;
Sodium hydrogensulfate: NaHSO4;
Sodium hydrogencarbonate: NaHCO3;
Sodium chloride: NaCl;
Sodium nitrate: NaNO3;
Calcium hydrogenphosphate: CaHPO4;
Magnesium sulfate: MgSO4;
Copper(II) sulfate: CuSO4.
Câu hỏi 2 trang 49 KHTN 8: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Trả lời:
AlCl3: aluminium chloride;
KCl: potassium chloride;
Al2(SO4)3: aluminium sulfate;
MgSO4: magnesium sulfate;
NH4NO3: ammonium nitrate;
NaHCO3: sodium hydrogencarbonate.
Câu hỏi 3 trang 49 KHTN 8: Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
Trả lời:
- Một số phương trình hoá học của phản ứng tạo thành muối KCl:
2K + 2HCl → 2KCl + H2
KOH + HCl → KCl + H2O
K2O + 2HCl → 2KCl + H2O
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
- Một số phương trình hoá học của phản ứng tạo thành muối MgSO4:
Mg + H2SO4 → MgSO4 + H2
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
MgO + H2SO4 → MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O.
Hoạt động trang 50 KHTN 8: Tìm hiểu tính chất hoá học của muối
Chuẩn bị: Các dung dịch: H2SO4 loãng, NaOH loãng, Na2SO4, CuSO4; 4 ống nghiệm: ống (1) chứa 1 đinh sắt đã được làm sạch, ống (2) và (3) mỗi ống nghiệm chứa khoảng 1 mL dung dịch BaCl2, ống (4) chứa khoảng 1 mL dung dịch CuSO4.
Tiến hành: ống (1) cho khoảng 2 mL dung dịch CuSO4; ống (2) cho khoảng 1 mL dung dịch H2SO4; ống (3) cho khoảng 1 mL dung dịch Na2SO4; ống (4) cho khoảng 1 mL dung dịch NaOH
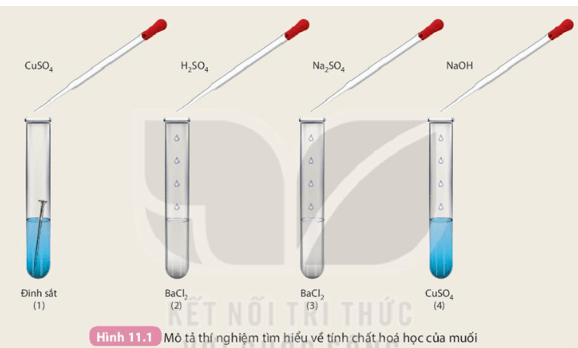
Quan sát hiện tượng xảy ra ở mỗi ống nghiệm và thực hiện yêu cầu:
1. Viết phương trình hoá học, giải thích hiện tượng xảy ra.
2. Thảo luận nhóm rút ra kết luận về tính chất hoá học của muối.
Trả lời:
1.
+ Ống nghiệm 1:
Hiện tượng: Đinh sắt tan dần, có lớp kim loại màu đỏ bám ngoài đinh sắt; Dung dịch trong ống nghiệm nhạt màu dần.
Phương trình hoá học: Fe + CuSO4 → FeSO4 + Cu.
+ Ống nghiệm 2:
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: BaCl2 + H2SO4 → BaSO4 + 2HCl.
+ Ống nghiệm 3:
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
+ Ống nghiệm 4:
Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4.
2. Một số tính chất hoá học của muối:
- Dung dịch muối có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới. Ví dụ: Fe + CuSO4 → FeSO4 + Cu.
- Muối có thể tác dụng với một số dung dịch acid tạo thành muối mới và acid mới. Sản phẩm của phản ứng tạo thành có ít nhất một chất là chất khí/ chất ít tan/ không tan … Ví dụ: BaCl2 + H2SO4 → BaSO4 + 2HCl.
- Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khí/ chất ít tan/ không tan … Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4.
- Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó có ít nhất một muối không tan hoặc ít tan. Ví dụ:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
|
Na2CO3 |
KCl |
Na2SO4 |
NaNO3 |
|
|
Ca(NO3)2 |
? | ? | ? | ? |
|
BaCl2 |
? | ? | ? | ? |
|
HNO3 |
? | ? | ? | ? |
Trả lời:
|
|
Na2CO3 |
KCl |
Na2SO4 |
NaNO3 |
|
Ca(NO3)2 |
× |
- |
× |
- |
|
BaCl2 |
× |
- |
× |
- |
|
HNO3 |
× |
- |
- |
- |
(“×”: xảy ra phản ứng; “-”: không xảy ra phản ứng)
Phương trình hoá học:
Ca(NO3)2 + Na2CO3 → CaCO3 + 2NaNO3
Ca(NO3)2 + Na2SO4 → CaSO4 + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
2HNO3 + Na2CO3 → 2NaNO3 + CO2 + H2O.
Câu hỏi trang 52 KHTN 8: Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây:
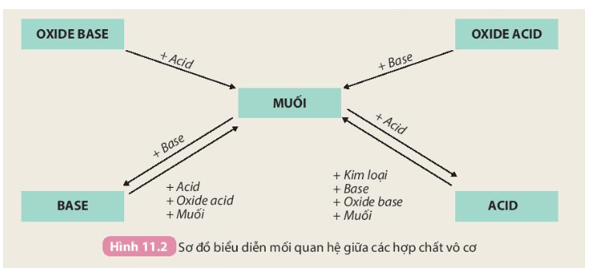
Trả lời:
- Tính chất của oxide:
+ Oxide base tác dụng với acid tạo thành muối và nước. Ví dụ:
CaO + 2HCl → CaCl2 + H2O.
+ Oxide acid tác dụng với dung dịch base tạo thành muối và nước. Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O.
- Tính chất của acid:
+ Tác dụng với kim loại tạo thành muối và khí. Ví dụ:
Fe + 2HCl → FeCl2 + H2.
+ Tác dụng với base tạo thành muối và nước. Ví dụ:
HCl + NaOH → NaCl + H2O.
+ Tác dụng với oxide base tạo thành muối và nước. Ví dụ:
H2SO4 + Na2O → Na2SO4 + H2O.
+ Tác dụng với muối tạo thành muối mới và acid mới. Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
- Tính chất của base:
+ Tác dụng với acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O.
+ Tác dụng với oxide acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + CO2 → CaCO3 + H2O.
+ Tác dụng với dung dịch muối tạo thành muối mới và base mới. Ví dụ:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
Xem thêm các bài giải KHTN 8 Kết nối tri thức hay, chi tiết khác:
Hoạt động trang 48 KHTN 8: Tìm hiểu về các phản ứng tạo muối
Câu hỏi 2 trang 49 KHTN 8: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Câu hỏi 3 trang 49 KHTN 8: Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
Hoạt động trang 50 KHTN 8: Tìm hiểu tính chất hoá học của muối
Câu hỏi trang 52 KHTN 8: Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.