Toptailieu.vn biên soạn và giới thiệu tới quý Thầy/Cô bộ Giáo án Hóa 11 sách Kết nối tri thức chuẩn theo mẫu Bộ GD & ĐT nhằm hỗ trợ quý Thầy/Cô trong quá trình lập kế hoạch giảng dạy và biên soạn giáo án môn Hóa 11. Rất mong nhận được những đóng góp ý kiến và sự đón nhận của quý Thầy/Cô.
Chỉ từ 400k mua trọn bộ Giáo án Hóa 11 Kết nối tri thức bản word chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
B1: Gửi phí vào tài khoản 01113002558311 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Giáo án Hóa 11 (Kết nối tri thức 2023) Bài 2: Cân bằng trong dung dịch nước
I. Mục tiêu
1) Kiến thức
- Nêu được khái niệm sự điện li, chất điện li, chất không điện li.
- Trình bày được thuyết Brϕnsted – Lowry về acid – base.
- Nêu được khái niệm và ý nghĩa của pH trong thực tiễn.
- Viết được biểu thức tính pH và biết cách sử dụng các chất chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như chất chỉ thị màu, quỳ tím, phenolphthalein, …
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid – base; chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+; Fe3+ và ��2-3.
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: Học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: nêu được khái niệm sự điện li, chất điện li, chất không điện li, thuyết Brϕnsted – Lowry về acid – base, khái niệm pH …
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: nêu được ý nghĩa của pH trong thực tiễn, liên hệ giá trị pH ở các bộ phận trong cơ thể với sức khoẻ con người, pH của đất, nước, tới sự phát triển của động, thực vật, ….
- Năng lực vận dụng kiến thức, kỹ năng đã học: sử dụng các chất chỉ thị để xác định pH của các dung dịch, thực hiện được thí nghiệm chuẩn độ acid – base …
3) Phẩm chất
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- 6 bộ dụng cụ, hoá chất thí nghiệm tìm hiểu về sự điện li (cho 6 nhóm).
- 6 bộ dụng cụ cho thí nghiệm làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím.
- 6 bộ dụng cụ, hoá chất cho thí nghiệm chuẩn độ acid, base.
- Giấy chỉ thị, máy đo pH.
- Thiết kế phiếu học tập, slide, máy tính, máy chiếu …
2. Học sinh
- Các nhóm HS chủ động phân công thành viên mang: hoa đậu biếc/ bắp cải tím; cốc nhựa; băng dính, giấy note (để dán nhãn cốc nhựa); giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
- SGK, vở ghi …
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung:
HS thảo luận theo cặp đôi, trả lời câu hỏi mở đầu, từ đó hình thành mục tiêu học tập.
|
CÂU HỎI MỞ ĐẦU Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?  |
c. Sản phẩm:
Câu trả lởi của HS, dự kiến:
pH là một đại lượng liên hệ trực tiếp với nồng độ H+ để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, trả lời câu hỏi mở đầu.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận theo cặp đôi trả lời câu hỏi.
- GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện 1 HS trả lời, các HS còn lại chú ý lắng nghe, nhận xét (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- Câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng/ sai mà căn cứ vào đó để dẫn dắt vào bài mới.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu sự điện li
a) Mục tiêu:
Nêu được khái niệm sự điện li.
b) Nội dung:
HS làm việc theo nhóm, thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn, từ đó hoàn thành các câu hỏi ở phiếu học tập 1, lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Lắp bộ dụng cụ thí nghiệm như mô tả ảnh sau và trả lời các câu hỏi bên dưới: 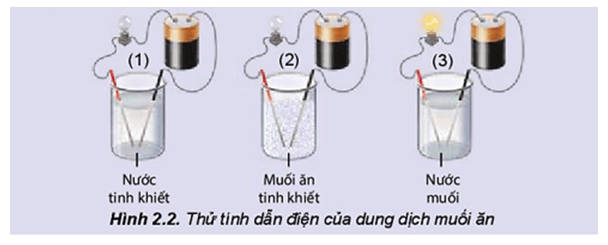
Câu 1. Hãy nhắc lại khái niệm dòng điện. Câu 2. Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)? Câu 3. Hãy giải thích sự tạo thành các hạt mang điện đó. |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1: Dòng điện là dòng dịch chuyển có hướng của các hạt mang điện.
Câu 2: Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là cation và anion.
Câu 3:
Giải thích:
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và Cl- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp làm 6 nhóm, yêu cầu các nhóm thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn như mô tả trong SGK hoặc phiếu học tập số 1, sau đó trả lời các câu hỏi có trong phiếu học tập. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm thực hiện thí nghiệm và hoàn thiện các câu hỏi trong phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận, các HS còn lại theo dõi và nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức, từ đó dẫn dắt vào khái niệm sự điện li. |
I. Sự điện li 1. Hiện tượng điện li Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra ion được gọi là các chất điện li. |
Hoạt động 3: Tìm hiểu chất điện li
a) Mục tiêu:
- Nêu được khái niệm chất điện li và chất không điện li.
b) Nội dung:
- Học sinh làm việc theo nhóm thực hành thí nghiệm và hoàn thành phiếu học tập số 2. Từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 2 Thí nghiệm 1: Thực hiện thí nghiệm thử tính dẫn điện với các dung dịch hydrochloric acid (HCl); sodium hydroxide (NaOH); saccharose (C12H22O11); ethanol (C2H5OH) và hoàn thành bảng sau: 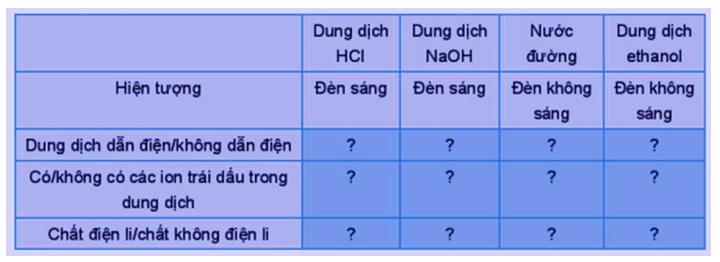
Thí nghiệm 2: Thực hiện thí nghiệm thử tính dẫn điện với các dung dịch HCl 0,1M và CH3COOH 0,1M. Cho biết: - Bóng đèn ở cốc đựng dung dịch nào sáng hơn? - So sánh số ion mang điện trong hai dung dịch, từ đó cho biết acid nào phân li mạnh hơn? |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Thí nghiệm 1:
|
|
Dung dịch HCl |
Dung dịch NaOH |
Nước đường |
Dung dịch ethanol |
|
Hiện tượng |
Đèn sáng |
Đèn sáng |
Đèn không sáng |
Đèn không sáng |
|
Dung dịch dẫn điện/không dẫn điện |
Dung dịch dẫn điện |
Dung dịch dẫn điện |
Dung dịch không dẫn điện |
Dung dịch không dẫn điện |
|
Có/không có các ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
|
Chất điện li/chất không điện li |
Chất điện li |
Chất điện li |
Chất không điện li |
Chất không điện li |
Thí nghiệm 2:
Hai dung dịch HCl và CH3COOH có cùng nồng độ là 0,1 M. Trường hợp cốc đựng dung dịch HCl 0,1 M bóng đèn sáng hơn Þ số hạt mang điện trong dung dịch HCl nhiều hơn số hạt mang điện trong dung dịch CH3COOH 0,1 M.
Vậy acid HCl phân li mạnh hơn.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Nhiệm vụ 1: Tìm hiểu chất điện li và chất không điện li Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, thực hiện thí nghiệm 1 và hoàn thiện yêu cầu kèm theo TN này trong phiếu học tập số 2. Từ đó rút ra khái niệm chất điện li và chất không điện li. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm thí nghiệm và hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả. - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. Từ đó dẫn dắt HS hình thành khái niệm chất điện li và chất không điện li. Nhiệm vụ 2: Tìm hiểu chất điện li mạnh và chất điện li yếu Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, thực hiện thí nghiệm 2 và hoàn thiện yêu cầu kèm theo TN này trong phiếu học tập số 2. Từ đó rút ra khái niệm chất điện li mạnh và chất điện li yếu và viết phương trình điện li. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm thí nghiệm và hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả. - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. Từ đó dẫn dắt HS hình thành khái niệm chất điện li mạnh và chất điện li yếu và viết phương trình điện li. |
2. Chất điện li a) Chất điện li và chất không điện li - Chất điện li là chất tan trong nước phân li ra ion. Ví dụ: hydrochloric acid; sodium hydroxide … - Chất không điện li là chất khi tan trong nước không phân li ra ion. Ví dụ: saccarose, ethanol… Sự phân li một chất thành các ion mang điện tích trái dấu trong dung dịch được biểu diễn bằng phương trình điện li. Ví dụ: NaOH(aq) → Na+(aq) + OH-(aq)
b) Tìm hiểu chất điện li mạnh và chất điện li yếu - Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Các chất điện li mạnh thường gặp là: Các acid mạnh: HCl; HNO3; H2SO4, … Các base mạnh: NaOH; KOH … Hầu hết các muối. Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng một mũi tên một chiều: HNO3 → H+ + NO3- - Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch. Những chất điện li yếu như: acid yếu CH3COOH; HClO; HF; H2CO3 …; base yếu như Cu(OH)2; Fe(OH)2 … Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau: CH3COOH ⇌ CH3COO- + H+
|
Hoạt động 4: Tìm hiểu thuyết acid – base của Brϕnsted – Lowry
a) Mục tiêu:
- Trình bày được thuyết acid – base của Brϕnsted – Lowry.
b) Nội dung:
- HS làm việc theo nhóm, hoàn thành phiếu học tập số 3 từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 3 Câu 1: Cho các dung dịch: HCl, NaOH, Na2CO3. a) Viết phương trình điện li của các chất trên. b) Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên. c) Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid? Chất nào là base? Câu 2: Nêu định nghĩa acid – base theo Brϕnsted – Lowry. Dựa vào thuyết acid – base của Br∅nsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau: a) CH3COOH + H2O ⇌ CH3COO- + H3O+ b) S2- + H2O ⇌ HS- + OH- |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1:
a) Phương trình điện li của các chất:
HCl → H+ + Cl-
NaOH → Na+ + OH-
Na2CO3 → 2Na+ +��2-3
b) Học sinh sử dụng máy đo xác định pH, tham khảo kết quả sau:
|
Dung dịch |
HCl (0,01 M) |
NaOH (0,01 M) |
Na2CO3 (0,01 M) |
|
pH |
2 |
12 |
11,17 |
|
Môi trường |
acid |
base |
base |
c) Trong môn Khoa học tự nhiên 8:
- Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
- Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
Þ Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, HCl là acid; NaOH là base.
Câu 2:
Thuyết Br∅nsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a) CH3COOH + H2O ⇌ CH3COO- + H3O+
Trong phản ứng trên: CH3COOH cho H+, CH3COOH là acid; H2O nhận H+, H2O là base.
b) S2- + H2O ⇌ HS- + OH-
Trong phản ứng trên: H2O cho H+, H2O là acid; S2- nhận H+, S2- là base.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, nghiên cứu SGK và hoàn thiện phiếu học tập số 3. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc nhóm, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả (mỗi nhóm báo cáo 1 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức và nêu ưu điểm của thuyết Br∅nsted – Lowry. |
II. Thuyết acid – base của Brϕnsted – Lowry. 1. Khái niệm acid và base theo thuyết Brϕnsted – Lowry. Thuyết Brϕnsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton (H+). 2. Ưu điểm của thuyết Brϕnsted – Lowry Thuyết Brϕnsted – Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH3 hoặc ion như CO32- cũng là base.
|
Hoạt động 5: Tìm hiểu khái niệm pH và ý nghĩa của pH trong thực tiễn.
a) Mục tiêu:
- Nêu được khái niệm pH và ý nghĩa của pH trong thực tiễn.
b) Nội dung:
- Học sinh làm việc theo nhóm, hoàn thiện phiếu học tập số 4 từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 4 1. pH của dung dịch được xác định như thế nào? Mối liên hệ giữa pH và môi trường dung dịch? 2. Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L. a) Tính nồng độ ion H+, pH của loại dầu gội nói trên. b) Môi trường của loại dầu gội trên là acid, base hay trung tính? 3. pH của dung dịch nào sau đây có giá trị nhỏ nhất? A. Dung dịch HCl 0,1 M. B. Dung dịch CH3COOH 0,1 M. C. Dung dịch NaCl 0,1 M. D. Dung dịch NaOH 0,01 M. 4. Nêu ý nghĩa của pH trong thực tiễn? |
c) Sản phẩm:
- Câu trả lời của học sinh. Dự kiến:
1. pH = -log[H+] hoặc [H+] = 10-pH.
Trong đó [H+] là nồng độ mol của ion H+.
Nếu dung dịch có [H+] = 10-a mol/ L thì pH = a.
Mối liên hệ giữa pH và môi trường dung dịch:
Môi trường acid: pH < 7.
Môi trường base: pH > 7.
Môi trường trung tính: pH = 7.
2.
a) Ta có: [H+].[OH]- = 10-14
⇔[�+]=10-14[��-]=10-1410-5,17=10-8,83
Ta có: pH = -log[H+] = 8,83.
b) pH > 7 nên môi trường của loại dầu gội trên là base.
3.
Đáp án đúng là: A
|
Dung dịch |
HCl 0,1 M |
CH3COOH 0,1 M |
NaCl 0,1 M |
NaOH 0,01 M |
|
pH |
1 |
> 1 |
7 |
12 |
4. Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, nghiên cứu SGK và hoàn thiện phiếu học tập số 4. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc nhóm, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả (mỗi nhóm báo cáo 2 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
III. Khái niệm pH và ý nghĩa của pH trong thực tiễn 1. Khái niệm pH pH = -log[H+] hoặc [H+] = 10-pH. Trong đó [H+] là nồng độ mol của ion H+. Nếu dung dịch có [H+] = 10-a mol/ L thì pH = a. Mối liên hệ giữa pH và môi trường dung dịch: Môi trường acid: pH < 7. Môi trường base: pH > 7. Môi trường trung tính: pH = 7. 2. Ý nghĩa của pH trong thực tiễn Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
|
Hoạt động 6: Tìm hiểu cách xác định pH
a) Mục tiêu:
- Biết cách sử dụng máy đo pH để xác định pH dung dịch.
- Biết cách sử dụng chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như giấy chỉ thị màu, quỳ tím, phenolphthalein…
b) Nội dung:
- HS làm việc theo nhóm, thực hiện hoạt động “làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím”.
Chuẩn bị:
Phần của HS (GV dặn từ buổi trước):
- Hoa đậu biếc (khoảng 50 g) hoặc bắp cải tím thái nhỏ (khoảng 100 g).
- Các cốc (đã được dán nhãn) đựng giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
Phần của GV:
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Giấy pH hoặc máy đo pH.
Tiến hành:
– Ngâm khoảng 50 g hoa đậu biếc/100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
– Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch: giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối và khuấy đều. Quan sát sự đổi màu của các dung dịch.
Hoàn thành thông tin theo mẫu bảng sau vào vở:
c) Sản phẩm:
Kết quả làm việc nhóm của HS, dự kiến:
|
|
Giấm ăn |
Nước C sủi |
Nước rửa bát |
Nước soda |
Nước muối |
|
pH |
3 |
3,5 |
9,5 |
3,8 |
7 |
|
Màu của chất chỉ thị |
Đỏ tím |
Đỏ tím |
Xanh vàng |
Đỏ tím |
Không đổi màu |
|
Môi trường acid/ base |
Acid |
Acid |
Base |
Acid |
Trung tính |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh đọc cách tiến hành thí nghiệm. Sau đó GV hệ thống lại và nêu quy tắc khi làm thực hành.
- Yêu cầu HS tiến hành theo nhóm: “làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím” theo hướng dẫn trong SGK.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm việc theo nhóm, thực hiện nhiệm vụ.
- GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Lần lượt từng nhóm báo cáo kết quả hoạt động.
- Các nhóm khác theo dõi.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết, chuẩn hoá kiến thức.
Hoạt động 7: Tìm hiểu sự thuỷ phân của các ion
a) Mục tiêu:
- Nêu được khái niệm phản ứng thuỷ phân.
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-.
b) Nội dung:
- Học sinh làm việc theo cặp đôi, nghiên cứu SGK, hoàn thành phiếu học tập số 5, từ đó lĩnh hội kiến thức:
|
PHIẾU HỌC TẬP SỐ 5 1. Thể nào là phản ứng thuỷ phân? 2. Giải thích về môi trường của các dung dịch: Na2CO3, AlCl3, FeCl3. |
c) Sản phẩm:
Câu trả lời của học sinh, dự kiến:
1. Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
2. Giải thích:
- Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion ��2-3 thuỷ phân trong nước tạo ra ion OH- theo phương trình:
��2-3+�2����-3+��-
Vậy dung dịch Na2CO3 có môi trường base.
- Trong dung dịch AlCl3 và FeCl3, ion Cl- không bị thuỷ phân, các ion Al3+ và Fe3+ bị thuỷ phân trong nước tạo ra ion H+ theo phương trình ở dạng đơn giản như sau:
Al3+ + H2O ⇌ Al(OH)2+ + H+
Fe3+ + H2O ⇌ Fe(OH)2+ + H+
Vậy các dung dịch AlCl3 và FeCl3 có môi trường acid.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo cặp đôi, nghiên cứu SGK và hoàn thiện phiếu học tập số 5. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc cặp đôi, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 HS báo cáo kết quả (mỗi HS báo cáo 1 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
IV. SỰ THUỶ PHÂN CỦA CÁC ION Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân. Ví dụ: - Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion ��2-3 thuỷ phân trong nước tạo ra ion OH- theo phương trình: ��2-3+�2����-3+��- Vậy dung dịch Na2CO3 có môi trường base. |
Hoạt động 7: Tìm hiểu nguyên tắc và thực hành chuẩn độ acid – base (hoạt động này được tiến hành tại phòng thí nghiệm)
a) Mục tiêu:
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid – base: Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
b) Nội dung:
Học sinh tiến hành thí nghiệm tại PTN của nhà trường, dưới sự hướng dẫn của GV, hoàn thành mẫu báo cáo thực hành sau:
|
Họ và tên: Lớp: BÁO CÁO THỰC HÀNH Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid) I. Nguyên tắc chung …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… II. Hoá chất, dụng cụ 1. Hoá chất …………………………………………………………………………………………………………………………………………………………………………………… 2. Dụng cụ …………………………………………………………………………………………………………………………………………………………………………………… III. Cách tiến hành …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… IV. Kết quả thí nghiệm …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… V. Trả lời câu hỏi 1. Nêu một số điểm cần chú ý trong quá trình chuẩn độ. 2. Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ. |
c) Sản phẩm:
Báo cáo thực hành của học sinh, dự kiến:
Họ và tên:
Lớp:
BÁO CÁO THỰC HÀNH
Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid)
I. Nguyên tắc chung
- Chuẩn độ là phương pháp xác định nồng độ của một chất bằng dung dịch chuẩn đã biết nồng độ.
- Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid):
Phương trình phản ứng: NaOH + HCl → NaCl + H2O
Khi các chất phản ứng vừa đủ với nhau, số mol HCl phản ứng bằng số mol NaOH.
Ta có: VHCl. CHCl = VNaOH. CNaOH]
Trong đó:
CHCl và CNaOH lần lượt là nồng độ mol của dung dịch HCl và dung dịch NaOH;
VHCl và VNaOH lần lượt là thể tích dung dịch HCl và dung dịch NaOH (cùng đơn vị đo).
Khi biết VHCl, VNaOH trong quá trình chuẩn độ và biết CHCl sẽ tính được CNaOH.
Thời điểm để kết thúc chuẩn độ được xác định bằng sự đổi màu của chất chỉ thị phenolphthalein.
II. Hoá chất, dụng cụ
1. Hoá chất
Dung dịch HCl 0,1 M; dung dịch NaOH nồng độ khoảng 0,1 M; dung dịch phenolphthalein.
2. Dụng cụ
Pipette 10 mL; burette 25 mL; bình tam giác 100 mL; bình tia nước cất; giá đỡ, kẹp burrete.
III. Cách tiến hành
– Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 – 2 giọt phenolphthalein.
– Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
– Mở khoá burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
- Ghi lại thể tích dung dịch NaOH đã dùng.
Tiến hành chuẩn độ ít nhất ba lần, ghi số liệu thực nghiệm và hoàn thành vào vở theo mẫu bảng sau:
IV. Kết quả thí nghiệm
- HS làm thí nghiệm và ghi kết quả.
V. Trả lời câu hỏi
1. Một số điểm cần chú ý trong quá trình chuẩn độ:
- Tránh để các hoá chất như dung dịch HCl, dung dịch NaOH bắn vào tay, mắt.
- Các dụng cụ thuỷ tinh (bình tam giác, burette, pipette …) dễ vỡ, cần cẩn thận.
2. Một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ:
+ Sai số do phương pháp hay quy trình chuẩn độ: phản ứng hoá học không hoàn toàn, chỉ thị đổi màu khi chưa đến điểm tương đương …
+ Sai số do dụng cụ như: dụng cụ chưa được rửa sạch, dụng cụ chưa được chuẩn hoá…
+ Sai số do người làm thí nghiệm: mắt nhìn không chính xác, cẩu thả trong thực nghiệm …
+ Sai số do hoá chất không tinh khiết.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
Nhiệm vụ giao HS làm ở nhà từ tiết trước: HS nghiên cứu SGK hoàn thành trước các mục I, II, III, V trong báo cáo thực hành. Để lại mục IV để sau khi thí nghiệm thì hoàn thiện.
Nhiệm vụ trong buổi học: GV nêu lại nội quy trong phòng thí nghiệm, yêu cầu HS làm việc theo nhóm, tiến hành thí nghiệm theo nội dung trong SGK.
HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thực hiện nhiệm vụ.
- GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV yêu cầu học sinh thu dọn vệ sinh vị trí thí nghiệm, hoàn thiện mục IV trong báo cáo thực hành và nộp lại báo cáo cho GV.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét tổng quan cho buổi học, chấm báo cáo của HS và trả bài vào tiết sau.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- Học sinh làm việc theo cặp đôi, hoàn thành phiếu bài tập sau:
PHIẾU BÀI TẬP
Câu 1: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường. B. Dung dịch rượu.
C. Dung dịch muối ăn. D. Nước cất.
Câu 2: Dung dịch chất nào sau đây không dẫn điện được?
A. C6H6 (benzene). B. Ca(OH)2 trong nước.
C. CH3COONa trong nước. D. NaHSO4 trong nước.
Câu 3: Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. MgCl2. B. HClO4.
C. Ba(OH)2. D. C6H12O6.
Câu 4: Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH. B. C2H5OH.
C. H2O. D. NaCl.
Câu 5: Trong dung dịch CH3COOH loãng (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, CH3COO-.
B. H+, CH3COO-, H2O.
C. CH3COOH, H+, CH3COO-, H2O.
D. CH3COOH, CH3COO-, H+.
Câu 6: Phương trình điện li viết đúng là
A. NaCl → Na2+ + Cl2-
B. Ca(OH)2 → Ca2+ + 2OH-
C. C2H5OH → C2H5+ + OH-
D. CH3COOH → CH3COO- + H+
Câu 7: Chất nào sau đây là acid theo Bronsted – Lowry?
A. NH3. B. NaCl.
C. CH3COOH. D. NaOH.
Câu 8: Môi trường trung tính là môi trường có
A. pH = 0. B. pH = 7.
C. pH > 7. D. pH < 7.
Câu 9: Đo PH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ của ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Câu 10: Các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có
pH lớn nhất là
A. NaOH. B. Ba(OH)2. C. NH3. D. NaCl.
c) Sản phẩm:
|
1 - C |
2 - A |
3 - D |
4 - D |
5 - C |
6 - B |
7 - C |
8 - B |
9 - C |
10 - B |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, hoàn thành phiếu bài tập.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- Học sinh làm việc theo cặp đôi, hoàn thành phiếu bài tập.
- GV đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện mỗi HS trả lời 1 câu trong phiếu bài tập.
- Các HS còn lại theo dõi, nhận xét (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết, chuẩn hoá kiến thức.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học và năng lực tìm hiểu đời sống.
b) Nội dung:
- GV yêu cầu học sinh làm việc cá nhân tại nhà, hoàn thiện nhiệm vụ sau:
|
Nêu cách xác định pH của đất trồng và trình bày một số biện pháp khắc phục khi đất trồng bị chua. |
c) Sản phẩm:
- Báo cáo của HS.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh, làm việc cá nhân, tại nhà trả lời câu hỏi đã đưa ở mục b, nội dung.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS nghiên cứu SGK, tài liệu tham khảo hoàn thiện nhiệm vụ.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV yêu cầu 5 HS nộp sản phẩm vào buổi học tiếp theo.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, đánh giá và cho điểm đối với những bài làm tốt.
Để mua Giáo án PPT Hóa 11 Kết nối tri thức năm 2023 mới nhất, mời Thầy/Cô liên hệ:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.