Toptailieu.vn biên soạn và giới thiệu Bài tập về phản ứng nhiệt nhôm hay, chi tiết, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức về Bài tập về phản ứng nhiệt nhôm, từ đó học tốt môn Hoá.
Bài tập về phản ứng nhiệt nhôm hay, chi tiết
A. Lý thuyết ngắn gọn
- Al khử được oxit của các kim loại đứng sau nó (oxit sắt, oxit crom,…):
2yAl + 3FexOy yAl2O3 + 3xFe
B. Phương pháp giải
Phương trình hóa học:
2yAl + 3MxOy yAl2O3 + 3xM
Với M là kim loại đứng sau Al trong dãy điện hóa
→ Hỗn hợp sau phản ứng nhiệt nhôm hoàn toàn gồm Al2O3, M và Al dư hoặc Al2O3, M và MxOy dư.
Bước 1: Xác định chất hết, chất dư
- Nếu hỗn hợp sau phản ứng tác dụng với NaOH sinh ra khí H2, chứng tỏ có Al dư
- Nếu hỗn hợp sau phản ứng gồm hai kim loại, chứng tỏ có M dư
- Nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch axit thu được khí H2, thì chưa thể xác định Al dư hay MxOy dư.
Bước 2: Tính toán theo yêu cầu bài toán
Chú ý:
- Nếu Al dư, khi đó có Al2O3 và Al phản ứng với dung dịch kiềm, các kim loại còn lại (trừ Zn) không phản ứng
2Al + 2OH– + 2H2O 2AlO2– + 3H2
Al2O3 + 2OH– 2AlO2– + H2O
Ta luôn có:
- Sử dụng các định luật bảo toàn: Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn electron để giải nhanh.
C. Ví dụ minh họa
Ví dụ 1: Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Cho sản phẩm sau phản ứng hoàn toàn tác dụng với lượng dư dung dịch NaOH thu được 0,672 lít khí (đktc). Giá trị của m là
A. 0,540.
B. 1,755.
C. 1,080.
D. 0,810.
Lời giải chi tiết
Cho sản phẩm sau phản ứng hoàn toàn tác dụng với dung dịch NaOH dư thu được khí H2
→ Al còn dư sau phản ứng nhiệt nhôm
→ Tính toán theo số mol Fe2O3
Phương trình hóa học:
Ta có:
→ nAl ban đầu = nAl phản ứng + nAl dư = 0,02 + 0,02 = 0,04 mol
→ m = 0,04.27 = 1,08 gam
Chọn C.
Ví dụ 2: Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp X gồm Al và Fe3O4, thu được hỗn hợp Y. Cho Y vào dung dịch NaOH dư, thu được 6,72 lít khí. Mặt khác, nếu cho Y vào dung dịch HCl dư thì thu được 26,88 lít khí. Giá trị của m là
A. 136,8.
B. 91,2.
C. 69,6.
D. 96,6.
Lời giải chi tiết
Ta có sơ đồ:
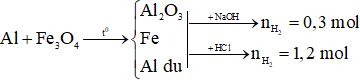
Xét Y + NaOH dư:
Xét Y + HCl dư:
Bảo toàn electron:
Bảo toàn nguyên tố Fe:
Bảo toàn nguyên tố O:
Bảo toàn nguyên tố Al:
→ m = 0,3.232 + 1.27 = 96,6 gam
Chọn D.
Ví dụ 3: Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng). Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Giá trị của a là
A. 0,9.
B. 1,3.
C. 0,5.
D. 1,5.
Lời giải chi tiết
Ta xét trong mỗi phần (23,3 gam)
Xét phần một + NaOH:
Ta có sơ đồ:
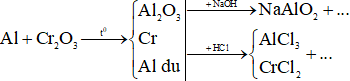
Ta có:
Mặt khác:
Xét phần hai + HCl:
Bảo toàn nguyên tố Al:
Bảo toàn nguyên tố Cr:
Bảo toàn nguyên tố Cl:
Chọn B.
D. Bài tập tự luyện
Câu 1: Nung hỗn hợp gồm 10,8 gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại trong Y là
A. 16,6 gam.
B. 11,2 gam.
C. 5,6 gam.
D. 22,4 gam.
Câu 2: Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al, Fe, Fe3O4 và Al2O3.
B. Al2O3, Fe và Fe3O4.
C. Al2O3 và Fe.
D. Al, Fe và Al2O3.
Câu 3: Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư, thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
A. 32,58
B. 33,39
C. 31,97
D. 34,10
Câu 4: Nung hỗn hợp gồm 7,2 gam bột Al và 15,2 gam bột Cr2O3 trong điều kiện không có oxi, sau phản ứng hoàn toàn, thu được chất rắn X. Khối lượng kim loại tự do có trong X là
A. 1,8 gam
B. 12,2 gam
C. 22,4 gam
D. 10,4 gam
Câu 5: Hỗn hợp X gồm Al và FexOy. Đun nóng m gam X (trong điều kiện không có oxi) đến phản ứng hoàn toàn thu được hỗn hợp Y. Biết Y phản ứng được tối đa với 0,28 mol NaOH trong dung dịch, thu được 6,72 lít H2 (đktc) và còn lại 5,04 gam chất rắn không tan. Công thức của oxit FexOy và giá trị m là
A. FeO và 14,52
B. Fe3O4 và 13,20
C. Fe2O3 và 14,52
D. Fe3O4 và 14,52
Câu 6: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng kết thúc thu được hỗn hợp rắn X. Cho X tác dụng hoàn toàn với dung dịch NaOH dư thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (đktc). Sục khí SO2 dư vào dung dịch Y thu được 39 gam kết tủa. Giá trị của m là
A. 45,6
B. 48,3
C. 36,7
D. 57,0
Câu 7: Nung hỗn hợp 15,2 gam gồm Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với HCl dư thoát ra V lít khí H2 ở đktc. Giá trị của V là
A. 10,08
B. 4,48
C. 3,36
D. 7,84
Câu 8: Trộn 5,4 gam bột Al với 12,8 gam Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí một thời gian thu được hỗn hợp X. Cho X vào dung dịch NaOH dư, phản ứng xong thu được 1,68 lít khí H2 (đktc). Giả sử chỉ có phản ứng khử oxit kim loại thành kim loại. Hiệu suất của phản ứng nhiệt nhôm là
A. 93,75%
B. 90,25%
C. 82,50%
D. 75,00%
Câu 9: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có O2), sau khi phản ứng kết thúc, thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl (loãng, nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH (đặc, nóng), sau khi các phản ứng kết thúc thì số mol NaOH đã phản ứng là
A. 0,14
B. 0,08
C. 0,16
D. 0,06
Câu 10: Nung hỗn hợp bột gồm Al và Fe2O3 (trong điều kiện không có oxi), thu được hỗn hợp chất rắn X. Chia X thành hai phần bằng nhau. Cho phần một vào dung dịch HCl dư thu được 7,84 lít khí H2 (đktc). Cho phần hai vào dung dịch NaOH dư thu được 3,36 lít khí H2 (đktc). Biết rằng các phản ứng đều xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là
A. 33,61%
B. 42,32%
C. 66,39%
D. 46,47%
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
A |
D |
C |
B |
D |
B |
D |
A |
B |
D |
Xem thêm các dạng bài tập Hoá học lớp 12 hay, chi tiết khác:
Các dạng toán CO2, SO2 tác dụng với dung dịch kiềm và cách giải
Các dạng bài toán về muối cacbonat và cách giải
Các dạng toán về sự lưỡng tính của Al(OH)3 và cách giải
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.