Toptailieu.vn biên soạn và giới thiệu lời giải KHTN 8 (Chân trời sáng tạo) Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học | Khoa học tự nhiên 8 hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi SGK KHTN 8 Bài 4 từ đó học tốt môn KHTN 8.
Nội dung bài viết
KHTN 8 (Chân trời sáng tạo) Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học | Khoa học tự nhiên 8
Giải KHTN 8 trang 23
Trả lời:
- Khi một phản ứng hoá học xảy ra, tổng khối lượng các chất trước và sau phản ứng không thay đổi.
- Để thuận tiện cho việc trình bày ngắn gọn một phản ứng hoá học, người ta sử dụng các công thức hoá học biểu diễn cho các chất, gọi là phương trình hoá học.
1. Định luật bảo toàn khối lượng
Trả lời:
Ban đầu cả dung dịch đều trong suốt, không có màu.
Trả lời:
Sau khi rót cốc (1) vào cốc (2):
+ Hiện tượng: có kết tủa trắng xuất hiện.
+ Dấu hiệu có phản ứng hoá học xảy ra: có kết tủa trắng xuất hiện.
Trả lời:
Tổng khối lượng của 2 cốc trước và sau phản ứng không thay đổi.
Giải KHTN 8 trang 24
Trả lời:
Trong phản ứng hoá học diễn ra sự thay đổi liên kết giữa các nguyên tử còn số nguyên tử mỗi nguyên tố vẫn giữ nguyên và khối lượng của các nguyên tử không đổi, vì vậy tổng khối lượng các chất được bảo toàn.
2. Phương trình hoá học
Trả lời:
Phương trình hoá học biểu diễn phản ứng hoá học bằng công thức hoá học của chất tham gia và chất sản phẩm.
Giải KHTN 8 trang 25
Trả lời:
Sơ đồ phản ứng dạng chữ:
Khí hydrogen + khí oxygen → nước.
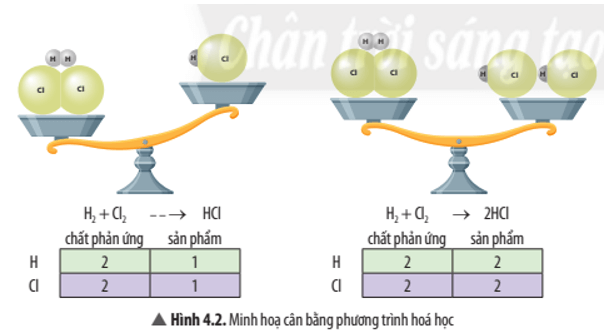
Trả lời:
Phương trình được cân bằng là: H2 + Cl2 → 2HCl
Do số nguyên tử của mỗi nguyên tố ở hai vế của phương trình là bằng nhau.
Giải KHTN 8 trang 26
Trả lời:
Sơ đồ phản ứng (*): P + O2 → P2O5.
- Ở vế trái: P + O2
+ Có 1 nguyên tử P và 2 nguyên tử O.
+ Số nguyên tử O lớn hơn.
- Ở vế phải: P2O5
+ Có 2 nguyên tử P và 5 nguyên tử O.
+ Số nguyên tử O lớn hơn
Câu hỏi thảo luận 7 trang 26 KHTN 8: Để cân bằng, bắt đầu cân bằng từ nguyên tố nào trước?
Trả lời:
Để cân bằng, bắt đầu cân bằng từ nguyên tố O trước.
Trả lời:
Ta làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước P2O5:
P + O2 → 2P2O5.
Để số nguyên tử O vế trái bằng với vế phải, ta thêm hệ số 5:
P + 5O2 → 2P2O5.
Câu hỏi thảo luận 9 trang 26 KHTN 8: Phương trình hoá học cho biết những thông tin gì?
Trả lời:
Phương trình hoá học cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng.
a) Na + O2 → Na2O
b) Na2CO3 + Ba(OH)2 → NaOH + BaCO3
c) Fe + O2 → Fe3O4
Trả lời:
a) Bước 1: Viết sơ đồ phản ứng:
Na + O2 → Na2O
Bước 2: Làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước Na2O.
Na + O2 → 2Na2O
Số nguyên tử Na vế trái và phải chưa bằng nhau, ta đặt hệ số 4 trước Na.
4Na + O2 → 2Na2O
Bước 3: Viết phương trình hoá học hoàn chỉnh:
4Na + O2 → 2Na2O
Tỉ lệ: 4 nguyên tử Na : 1 phân tử O2 : 2 phân tử Na2O.
Hay cứ 4 nguyên tử Na tác dụng với 1 phân tử O2 tạo ra 2 phân tử Na2O.
b) Bước 1: Viết sơ đồ phản ứng
Na2CO3 + Ba(OH)2 → NaOH + BaCO3
Bước 2: Số nhóm (OH) ở vế phải và vế trái chưa bằng nhau, ta đặt hệ số 2 trước NaOH.
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Bước 3: Viết phương trình hoá học hoàn chỉnh:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Tỉ lệ: 1 phân tử Na2CO3 : 1 phân tử Ba(OH)2 : 2 phân tử NaOH : 1 phân tử BaCO3.
Hay cứ 1 phân tử Na2CO3 tác dụng với 1 phân tử Ba(OH)2 tạo ra 2 phân tử NaOH và 1 phân tử BaCO3.
c) Bước 1: Viết sơ đồ phản ứng:
Fe + O2 → Fe3O4
Bước 2: Số nguyên tử O ở vế phải và vế trái chưa bằng nhau, ta thêm hệ số 2 vào O2:
Fe + 2O2 → Fe3O4
Số nguyên tử Fe ở vế trái và vế phải chưa bằng nhau, ta thêm hệ số 3 vào Fe:
3Fe + 2O2 → Fe3O4
Bước 3: Viết phương trình hoá học hoàn chỉnh:
3Fe + 2O2 → Fe3O4
Tỉ lệ: 3 nguyên tử Fe : 2 phân tử O2 : 1 phân tử Fe3O4.
Hay cứ 3 nguyên tử Fe tác dụng với 2 phân tử O2 được 1 phân tử Fe3O4.
Trả lời:
Bước 1: Viết sơ đồ phản ứng:
Al + O2 → Al2O3
Bước 2: Ta làm chẵn số nguyên tử O vế phải bằng cách thêm 2 vào Al2O3:
Al + O2 → 2Al2O3
Để số nguyên tử O vế trái bằng vế phải, ta thêm hệ số 3 vào O2:
Al + 3O2 → 2Al2O3
Số nguyên tử Al vế trái chưa bằng vế phải, ta thêm hệ số 4 vào Al:
4Al + 3O2 → 2Al2O3
Bước 3: Viết phương trình hoá học hoàn chỉnh:
4Al + 3O2 → 2Al2O3
Người ta thường dùng nhôm để chế tạo đồ dùng và dụng cụ nhà bếp do nhôm bền, nhẹ, dẫn nhiệt tốt.
Xem thêm các bài giải SGK KHTN 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Biến đổi vật lí và biến đổi hoá học
Bài 3: Phản ứng hoá học và năng lượng trong các phản ứng hoá học
Bài 5: Mol và tỉ khối của chất khí
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.