Toptailieu.vn biên soạn và giới thiệu lời giải KHTN 8 (Chân trời sáng tạo) Bài 7: Nồng độ dung dịch | Khoa học tự nhiên 8 hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi SGK KHTN 8 Bài 7 từ đó học tốt môn KHTN 8.
Nội dung bài viết
KHTN 8 (Chân trời sáng tạo) Bài 7: Nồng độ dung dịch | Khoa học tự nhiên 8
Giải KHTN 8 trang 35
Trả lời:
Đại lượng dùng để đánh giá độ đặc, loãng của dung dịch là nồng độ.
1. Dung dịch
Trả lời:
- Trong dung dịch muối: chất tan là muối ăn (NaCl); dung môi là nước.
- Trong dung dịch đường: chất tan là đường (C12H22O11); dung môi là nước.
Câu hỏi thảo luận 2 trang 35 KHTN 8: Tại sao lại gọi nước đường, nước muối là các dung dịch?
Trả lời:
Khi hoà tan đường hay muối (chất rắn) vào nước (chất lỏng) sẽ tạo thành nước đường hay nước muối (hỗn hợp đồng nhất).
Do đó có thể gọi nước đường, nước muối là các dung dịch.
2. Độ tan của một chất trong nước
Câu hỏi thảo luận 3 trang 35 KHTN 8: Độ tan của một chất trong nước phụ thuộc vào những yếu tố nào?
Trả lời:
Độ tan của một chất trong nước phụ thuộc vào nhiệt độ. Ngoài ra đối với chất khí, độ tan phụ thuộc vào nhiệt độ và áp suất.
Giải KHTN 8 trang 36
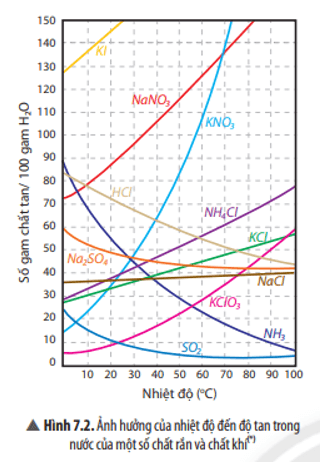
Trả lời:
- Độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ số ít trường hợp như Na2SO4 …)
- Độ tan của chất khí sẽ tăng khi giảm nhiệt độ.
Trả lời:
Áp dụng công thức:
S=mctmdm×100=76,75250×100=30,7 (g/100g nước).
Vận dụng trang 36 KHTN 8: Hãy giải thích tại sao:
a) Khi pha nước chanh đá, người ta thường hoà tan đường hoặc muối ăn vào nước nóng, sau đó mới cho đá lạnh vào.
b) Trong sản xuất nước ngọt có gas, người ta thường nén khí (carbon dioxide) ở áp suất cao.
Trả lời:
a) Đường hoặc muối ăn tan tốt trong nước nóng, tan kém trong nước lạnh. Do đó khi pha nước chanh đá, người ta thường hoà tan đường hoặc muối ăn vào nước nóng, sau đó mới cho đá lạnh vào.
b) Độ tan của khí carbon dioxide tăng khi ở áp suất cao. Do đó trong sản xuất nước ngọt có gas, người ta thường nén khí (carbon dioxide) ở áp suất cao.
3. Nồng độ dung dịch

Trả lời:
3 dung dịch của cùng một chất nhưng màu sắc của chúng lại khác nhau do nồng độ của chúng khác nhau.
Trả lời:
Công thức tính nồng độ phần trăm của dung dịch:
C%=mctmdd×100(%)
Để tính nồng độ phần trăm của dung dịch ta cần biết những thông tin:
+ Khối lượng chất tan (mct);
+ Khối lượng dung dịch (mdd).
Giải KHTN 8 trang 37
Trả lời:
Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan
= 129 + 21 = 150 gam.
Nồng độ phần trăm của dung dịch KNO3 thu được là:
C%=mctmdd×100(%)=21150×100(%)=14(%).
Câu hỏi thảo luận 7 trang 37 KHTN 8: Làm thế nào để xác định được nồng độ mol của dung dịch?
Trả lời:
Công thức tính nồng độ mol của dung dịch:
CM=nVdd
Như vậy để tính nồng độ mol của dung dịch cần biết: số mol chất tan và thể tích dung dịch.
Trả lời:
Số mol chất tan: nCuSO4=16160=0,1(mol);
Đổi 200 ml = 0,2 lít.
Nồng độ mol của dung dịch CuSO4 là:
CM=nVdd=0,10,2=0,5(M).
4. Pha chế dung dịch
Giải KHTN 8 trang 38
Trả lời:
Dụng cụ và hoá chất: 1 ống đong có dung tích 150 mL, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, muối ăn, nước cất.
Tính toán:
Số mol chất tan: nNaCl = 0,1 × 1 = 0,1 (mol);
Khối lượng của 0,1 mol NaCl: mNaCl = 0,1 × 58,5 = 5,85 (gam).
Cách pha chế:
- Cân lấy 5,85 gam NaCl cho vào ống đong có dung tích 150 mL.
- Rót từ từ nước cất vào ống đong và khuấy nhẹ cho đủ 100 mL dung dịch, ta thu được 100 mL dung dịch NaCl.
Trả lời:
Khối lượng muối có trong 1 000 kg nước biển là:
mNaCl=1000×3,5100=35(kg)
Gọi x (kg) là khối lượng nước ngọt mà bác nông dân phải thêm vào hồ (x > 0).
Khi đó lượng nước trong hồ sau khi đổ nước ngọt là: 1 000 + x (kg).
Theo bài ra ta có phương trình:
351000+x×100=1⇔x=2500.
Vậy bác nông dân phải thêm vào hồ 2 500 kg nước ngọt.
Xem thêm các bài giải SGK KHTN 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Mol và tỉ khối của chất khí
Bài 6: Tính theo phương trình hoá học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.