Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Kết nối tri thức) Bài 19: Dẫn xuất halogen hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
Hoá học 11 (Kết nối tri thức) Bài 19: Dẫn xuất halogen
Lời giải:
Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử halogen, được dẫn xuất halogen của hydrocarbon.
Lời giải:
Các đồng phân cấu tạo của dẫn xuất halogen có công thức phân tử C4H9Cl:
CH3 – CH2 – CH2 – CH2 – Cl: 1 – chlorobutane.
CH3 – CHCl – CH2 – CH3: 2 – chlorobutane.
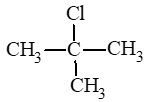 : 2 – chloro – 2 – methylpropane.
: 2 – chloro – 2 – methylpropane.
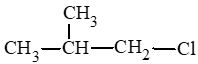 : 1 – chloro – 2 – methylpropane.
: 1 – chloro – 2 – methylpropane.
Câu hỏi 2 trang 113 Hóa học 11: Gọi tên theo danh pháp thay thế các dẫn xuất halogen sau đây:

Lời giải:
Các tên gọi tương ứng:
a) bromoethane;
b) 2 – iodopropane;
c) chloroethene.
d) fluorobenzene.
Câu hỏi 3 trang 114 Hóa học 11: Viết công thức cấu tạo các dẫn xuất halogen có tên gọi sau đây:
a) iodoethane;
b) trichloromethane;
c) 2 – bromopentane;
d) 2 – chloro – 3 – methylbutane.
Lời giải:
a) iodoethane: CH3 – CH2 – I.
b) trichloromethane: 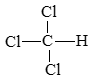 .
.
c) 2 – bromopentane: CH3 – CHBr – CH2 – CH2 – CH3.
d) 2 – chloro – 3 – methylbutane: 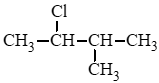 .
.

Từ giá trị năng lượng C – X ở trên, hãy so sánh khả năng phân cắt liên kết C – X của các dẫn xuất halogen.
Lời giải:
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học. Năng lượng liên kết càng lớn, liên kết càng khó bị phân cắt.
Ta có: EC – F > EC – Cl > EC – Br > EC – I.
Vậy khả năng phân li liên kết tăng dần theo thứ tự: C – F; C – Cl; C – Br; C – I.
Hoạt động trang 114 Hóa học 11: Nghiên cứu phản ứng thuỷ phân bromoethane
Phản ứng thuỷ phân bromoethane được thực hiện như sau:
– Cho khoảng 1 mL C2H5Br vào ống nghiệm (1), thêm khoảng 3 mL nước cất rồi lắc đều. Để hỗn hợp tách thành hai lớp, lấy phần trên của hỗn hợp nhỏ vào ống nghiệm có chứa sẵn 1 mL dung dịch AgNO3. Nếu thấy có kết tủa cần lặp lại đến khi không còn kết tủa (nước rửa không còn ion halogen).
– Thêm 2 mL dung dịch NaOH 10% vào ống nghiệm (1).
– Lắc nhẹ ống nghiệm rồi ngâm vào cốc nước nóng khoảng 5 phút, thỉnh thoảng lắc đều ống nghiệm, đề nguội rồi lấy khoảng 1 mL chất lỏng ở phần trên ống nghiệm (1) và chuyển sang ống nghiệm (2).
– Trung hòa base dư ở ống nghiệm (2) bằng dung dịch HNO3 (thử bằng giấy chỉ thị pH) rồi nhỏ thêm vài giọt dung dịch AgNO3 1%, quan sát thấy có kết tủa vàng nhạt xuất hiện.
Trả lời câu hỏi và thực hiện yêu cầu sau:
1. Tại sao ban đầu hỗn hợp lại tách thành hai lớp, bromoethane nằm ở lớp nào?
2. Kết tủa xuất hiện ở ống nghiệm (2) sau khi thêm dung dịch AgNO3 vào là chất gì? Tại sao cần phải trung hoà dung dịch base dư trước khi cho dung dịch AgNO3 1% vào ống nghiệm (2)?
3. Dự đoán sản phẩm và viết phương trình hoá học của các phản ứng xảy ra trong quá trình thí nghiệm.
Lời giải:
1. Ban đầu hỗn hợp tách thành hai lớp do bromoethane không tan trong nước. Trong đó, bromoethane ở lớp dưới do nặng hơn nước.
2. Kết tủa xuất hiện ở ống nghiệm (2) sau khi thêm AgNO3 là AgBr.
Cần trung hoà base dư trước khi cho dung dịch AgNO3 để tránh sinh ra kết tủa Ag2O làm sai lệch kết quả thí nghiệm. Cụ thể, nếu còn base dư có thêm phản ứng:
AgNO3 + NaOH → AgOH + NaNO3
2AgOH (không bền) → Ag2O + H2O.
3. Các phương trình hoá học xảy ra trong quá trình thí nghiệm:
+ Rửa ion halogen: Br− + Ag+ → AgBr.
+ NaOH tác dụng với C2H5Br:
NaOH + C2H5Br to→ NaBr + C2H5OH.
+ Trung hoà base dư:
NaOH (dư) + HNO3 → NaNO3 + H2O.
+ Cho dung dịch trong ống nghiệm (2) tác dụng với AgNO3:
NaBr + AgNO3 → AgBr(kết tủa vàng) + NaNO3.
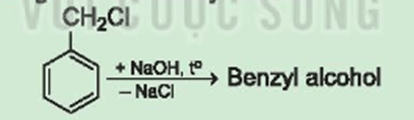
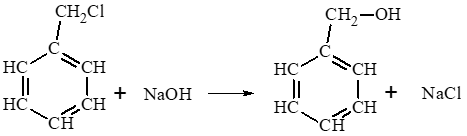
Lời giải:
Công thức của benzyl alcohol:
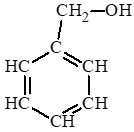
Giải thích bằng phương trình hoá học:
Lời giải:
CH3CHClCH3 +NaOH/C2H5OH,to→ CH2 = CH – CH3 + HCl
Lời giải:
Ta có sơ đồ tách:
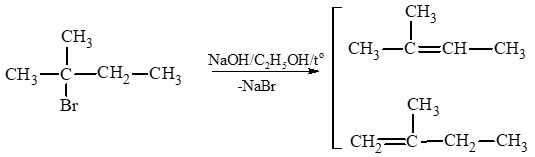
Áp dụng quy tắc tách Zaitsev (Zai – xép): Trong phản ứng tách hydrogen halide, nguyên tử halogen bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
Vậy sản phẩm chính là:
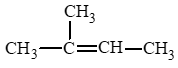
Lời giải:
Dẫn xuất halogen có nhiều ứng dụng trong đời sống, công nghiệp hoá chất và y học.
- Các dẫn xuất halogen như chloroform (CHCl3), carbon tetrachloride (CCl4), methylene dichloride (CH2Cl2), … là những chất lỏng dễ bay hơi, hoà tan được nhiều chất hữu cơ nên chúng được sử dụng là dung môi trong phòng thí nghiệm và công nghiệp.

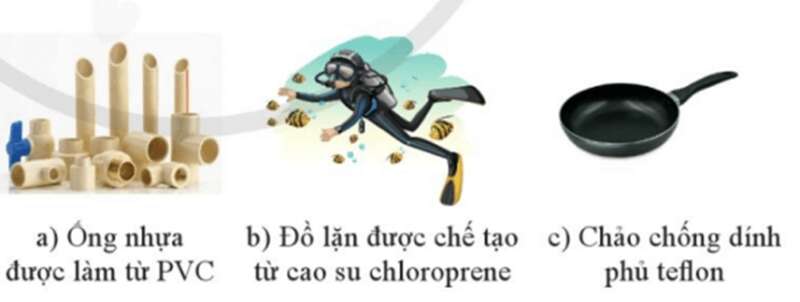
- Một số dẫn xuất halogen được sử dụng làm monomer trong tổng hợp các polymer. Ví dụ, từ vinyl chloride tổng hợp được poly(vinyl chloride) (nhựa PVC) để làm ống nước, vỏ bọc dây điện, vải giả da, … Từ 2 – chlorobuta – 1,3 – diene tổng hợp ra poly(2 – chlorobuta – 1,3 – diene) ứng dụng trong sản xuất cao su chloroprene để chế tạo ống, băng tải cao su chịu nhiệt dùng trong khai thác mỏ; các sản phẩm đúc, con dấu, vòng đệm, … Trùng hợp tetrafluoroethylene thu được polytetrafluoroethylene hay teflon được ứng dụng trong sản xuất chảo chống dính, vật liệu cách điện, các ống chịu hoá chất, bình phản ứng …
- Dẫn xuất halogen còn được sử dụng để tổng hợp alcohol, ether, … hoặc các chất cơ nguyên tố.
- Dẫn xuất halogen có hoạt tính sinh học đa dạng. Ví dụ, chloroform, ethyl chloride, halothane được sử dụng làm chất gây mê trong y học. Ethyl chloride được dùng làm chất giảm đau tạm thời cho các chấn thương nhỏ trong thể thao. Methyl bromide là một chất khử trùng, tiêu diệt nhiều loại dịch hại như nhện, ve, nấm, côn trùng … Các chất như 2,4 – dichlorophenoxyacetic acid (2,4 – D) và 2,4,5 – trichlorophenoxyacetic acid (2,4,5 – T) ở nồng độ thấp (vài phần triệu) có tác dụng kích thích sinh trưởng thực vật nhưng ở nồng độ cao có tác dụng diệt cây cỏ nên được dùng làm chất diệt cỏ, phát quang rừng rậm …

- Các hợp chất chỉ chứa chlorine, fluorine và carbon trong phân tử được gọi chung là các hợp chất CFC hay freon trước đây được sử dụng trong công nghệ làm lạnh (điều hoà, tủ lạnh) nhưng do các chất này có thể phá huỷ tầng ozone nên hiện nay các hợp chất CFC này đã được thay thế bằng các hợp chất HFC (tức hydrofluorocarbon).
Lời giải:
Một số dẫn xuất halogen chứa đồng thời chlorine, fluorine được gọi chung là chlorofluorocarbon (viết tắt CFC). Các hợp chất này gây ảnh hưởng đến tầng ozone nên hiện nay bị hạn chế và cấm sử dụng. Hiện nay, hợp chất CFC được thay thế bởi các dẫn xuất halogen không có chứa chlorine như hydrofluorocarbon (HFC), hydrofluoroolefin (HFO).
Như vậy loại chất làm lạnh không nên sử dụng là: R22 (CHClF2).
Lời giải:
Trước đây, các dẫn xuất của chlorine được sử dụng phổ biến trong nông nghiệp Việt Nam để làm thuốc bảo vệ thực vật, chất kích thích sinh trưởng như thuốc trừ sâu, diệt côn trùng (dichlorodiphenyltrichloroethane – DDT, hexachlorocyclohexane – 666), thuốc diệt cỏ, làm rụng lá (2,4 – dichlorophenoxyacetic acid - 2,4 – D và 2,4,5 – trichlorophenoxyacetic acid - 2,4,5 – T) … Đây là các chất hoá học, có đặc tính khó phân huỷ, tồn dư lâu trong môi trường và có tác hại đến sức khoẻ con người, do đó hiện nay các loại hợp chất này đã bị hạn chế và cấm sử dụng, thay vào đólà các thuốc bảo vệ thực vật có các hoạt chất sinh học như: Abamectin; azadirachtin; rotenon ….
Để sử dụng các loại thuốc bảo vệ thực vật đảm bảo an toàn, hiệu quả cần giảm thiểu, tránh lạm dụng thuốc bảo vệ thực vật hoá học thay vào đó là thuốc bảo vệ thực vật có nguồn gốc sinh học thân thiện với môi trường.
Xem thêm các bài giải Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Hoá học 11 (Kết nối tri thức) Bài 17: Arene (Hydrocarbon thơm)
Hoá học 11 (Kết nối tri thức) Bài 18: Ôn tập chương 4
Hoá học 11 (Kết nối tri thức) Bài 20: Alcohol
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.