Toptailieu.vn xin giới thiệu Lý thuyết Hợp chất carbonyl (Kết nối tri thức) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết Hợp chất carbonyl (Kết nối tri thức) hay, chi tiết | Lý thuyết Hóa học 11
A. Lý thuyết Hợp chất carbonyl
1. Khái niệm, danh pháp
a. Khái niệm
Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm chức carbonyl. Nhóm chức carbonyl có trong aldehyde, ketone,...
b. Danh pháp
* Danh pháp thay thế:
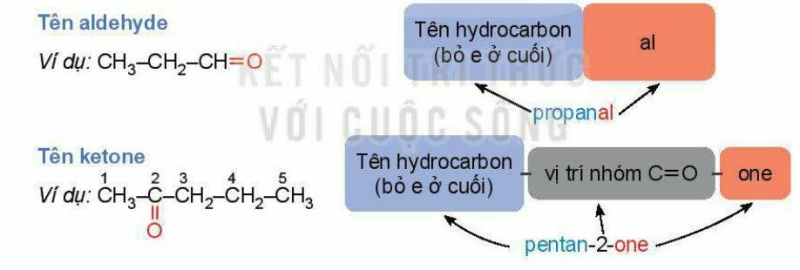
* Tên gọi thông thường:
Một số aldehyde, ketone đơn giản được gọi theo tên thông thường có nguồn gốc lịch sử. Tên thông thường của các aldehyde có nguồn gốc từ tên của acid tương ứng.
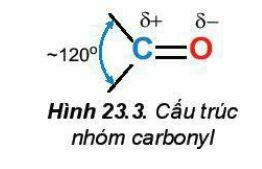
2. Đặc điểm cấu tạo
Liên kết đôi C=O phân cực về phía nguyên tử oxygen:
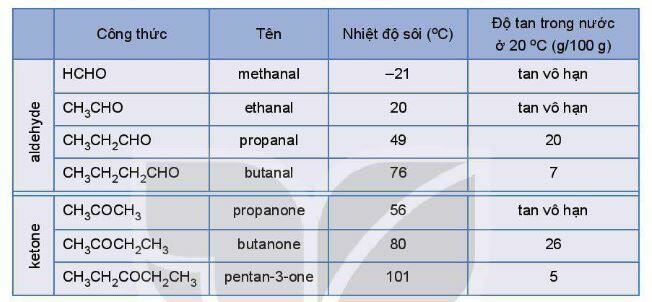
3. Tính chất vật lí
- Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương.
- Ở nhiệt độ thường, các aldehyde ở thể khí và có phân tử khối nhỏ, tan tốt trong nước. Khi số nguyên tử carbon tăng thì độ tan của hợp chất carbonyl giảm dần.
4. Tính chất hoá học
a. Phản ứng khử
Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4,... (kí hiệu [H]) tạo thành các alcohol tương ứng, aldehyde bị khử tạo thành alcohol bậc I, ketone bị khử tạo thành alcohol bậc II.
b. Phản ứng oxi hóa aldehyde
* Oxi hóa aldehyde bởi nước:
Aldehyde bị oxi hoá bởi nước bromine tạo thành carboxylic acid.
Ví dụ: CH3CHO + Br2 + H2O → CH3COOH + 2HBr
* Oxi hoá aldehyde bởi thuốc thử Tollens
Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hoá.
* Oxi hoá aldehyde bång copper(II) hydroxide
Aldehyde có thể bị oxi hoá bởi copper(II) hydroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper(I) oxide (Cu2O) màu đỏ gạch:
RCHO + 2 Cu(OH)2 + NaOH → RCOONa + Cu2O + 3H20
c. Phản ứng cộng
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đối C=O.
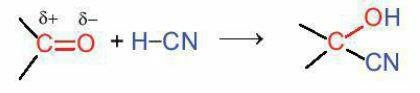
d. Phản ứng tạo iodoform
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2, trong môi trường kiềm.

Phản ứng tạo sản phẩm kết tủa indoform nên phản ứng này được gọi là phản ứng lodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl.
5. Ứng dụng
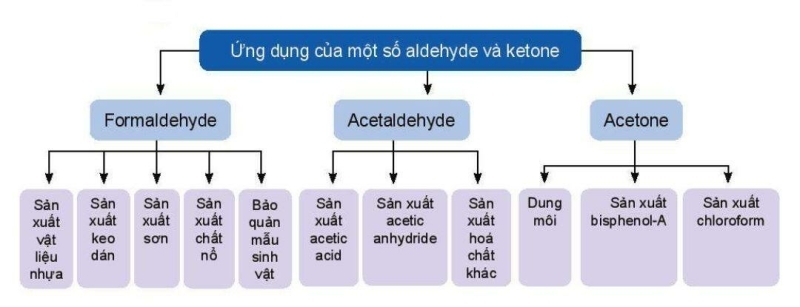
6. Điều chế
Một số hợp chất carbonyl được tổng hợp trong công nghiệp bằng phương pháp oxi hoá các hydrocarbon, oxi hóa ethylene thành acetaldehyde, oxi hoá cumene thành acetone.
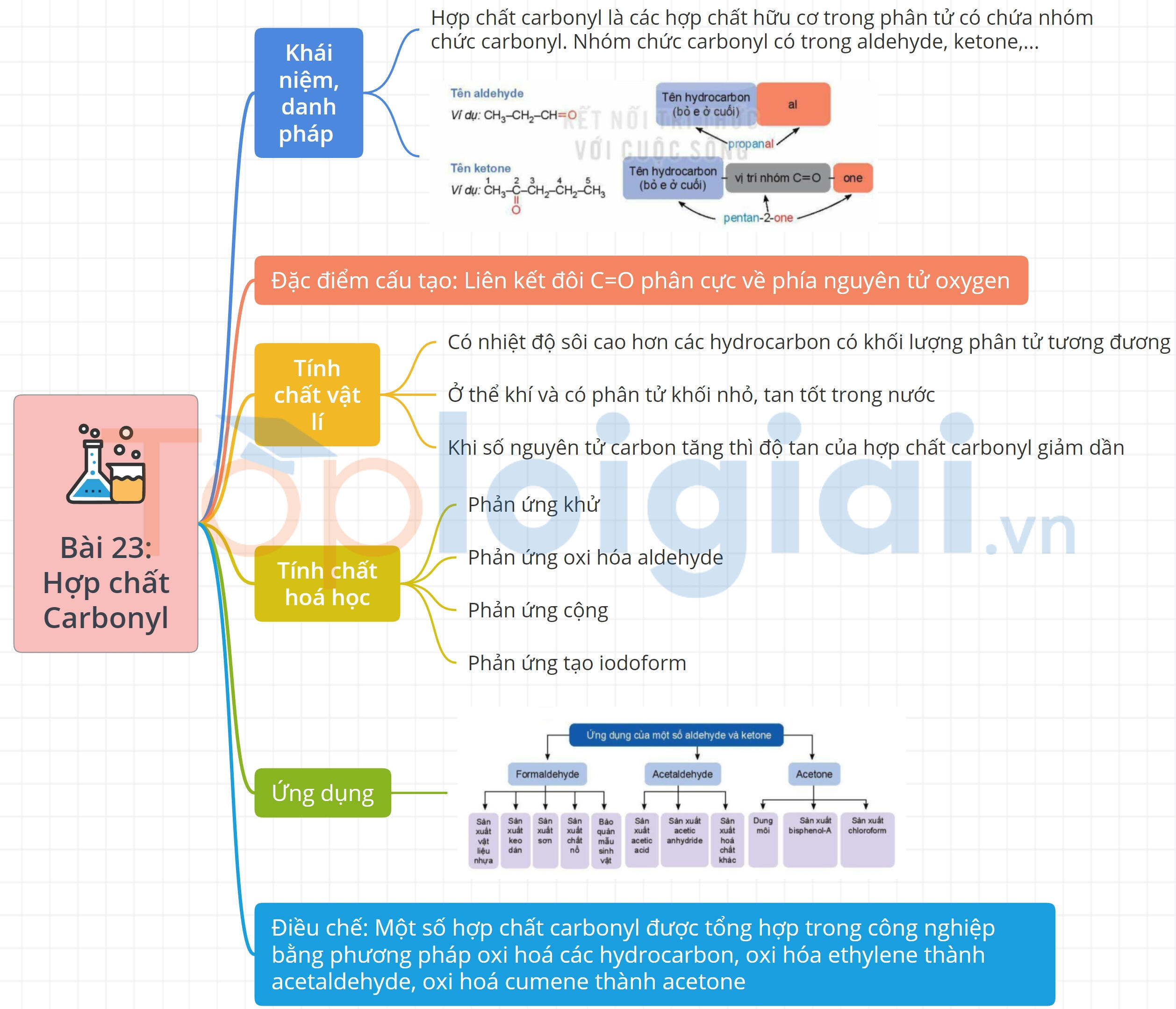
Sơ đồ tư duy Hợp chất carbonyl
B. Trắc nghiệm Hợp chất carbonyl
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.