Lý thuyết KHTH 8 (Chân trời sáng tạo) Bài 6: Tính theo phương trình hóa học . Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Lý thuyết KHTH 8 (Chân trời sáng tạo) Bài 6: Tính theo phương trình hóa học
Bài giảng Bài 6: Tính theo phương trình hóa học
A. Kiến thức trọng tâm KHTN 8 Bài 6: Tính theo phương trình hoá học
I. Tính theo phương trình hoá học
1. Khái niệm chất thiếu và chất dư trong phản ứng hoá học
Một phản ứng hoàn toàn khi có ít nhất một chất tham gia phản ứng hết sau khi kết thúc phản ứng.
Chất tham gia phản ứng nào hết trước được gọi là chất thiếu và chất tham gia phản ứng nào vẫn còn lại sau phản ứng sẽ gọi là chất dư.
Một phản ứng không hoàn toàn thì các chất tham gia phản ứng đều chưa hết. Trong trường hợp các chất tham gia phản ứng đều hết, người ta nói phản ứng vừa đủ. Như vậy, phản ứng vừa đủ là một trường hợp riêng của phản ứng hoàn toàn.
2. Tính khối lượng chất tham gia và sản phẩm
Để tính theo phương trình hoá học, ta tiến hành theo các bước sau:
- Viết phương trình hoá học và xác định tỉ lệ số mol các chất trong phản ứng.
- Xác định số mol chất phản ứng hoặc chất tạo thành theo dữ kiện đề bài.
- Dựa vào phương trình hoá học và lượng chất đã biết tìm số mol chất còn lại.
- Chuyển đổi số mol chất thành khối lượng hoặc thể tích (đối với chất khí ở đkc) theo yêu cầu của đề bài.
Ví dụ:
Đốt cháy hoàn toàn 6,2 gam phosphorus trong khí oxygen. Hãy tính thể tích khí oxygen (đkc) và khối lượng sản phẩm tạo thành theo phản ứng: 4P + 5O2 → 2P2O5.
Hướng dẫn giải:
Phương trình hoá học: 4P + 5O2 → 2P2O5
Tỉ lệ các chất: 4 : 5 : 2
Số mol phosphorus đã bị đốt cháy: 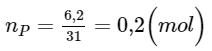
Theo tỉ lệ mol của phản ứng, ta có:
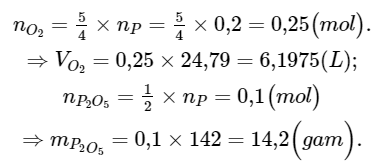
II. Hiệu suất phản ứng
1. Khái niệm
Hiệu suất phản ứng cho biết khả năng phản ứng xảy ra đến mức độ nào, được tính bằng tỉ số giữa lượng sản phẩm thực tế và lượng sản phẩm theo lí thuyết.
2. Tính hiệu suất phản ứng
Hiệu suất của phản ứng được kí hiệu là H%.
Để tính được hiệu suất H% của một phản ứng hoá học, ta thực hiện các bước sau:
Bước 1: Xác định lượng sản phẩm (mol, khối lượng, thể tích) thu được theo lí thuyết. Lượng sản phẩm theo lí thuyết được tính qua phương trình phản ứng (theo lượng chất thiếu tham gia phản ứng) với giả thiết phản ứng xảy ra hoàn toàn (H = 100%).
Bước 2: Xác định lượng sản phẩm thu được theo thực tế.
Bước 3: Tính hiệu suất theo công thức:

Ví dụ:
Cho 0,50 mol khí hydrogen tác dụng với 0,45 mol hơi iodine thu được 0,60 mol khí hydrogen iodide. Tính hiệu suất phản ứng.
Hướng dẫn giải:
Phương trình hoá học: H2 + I2 → 2HI
Tỉ lệ các chất: 1 : 1 : 2
Giả sử hiệu suất đạt 100% thì I2 hết, H2 dư, vậy lượng HI thu được theo lí thuyết tính theo I2. Theo tỉ lệ mol của phản ứng, ta có:
![]()
Hiệu suất của phản ứng là:
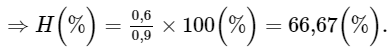
B. Bài tập KHTN 8 Bài 6: Tính theo phương trình hoá học
Đang cập nhật
Xem thêm các bài lý thuyết Khoa học tự nhiên 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Mol và tỉ khối của chất khí
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.