Toptailieu.vn xin giới thiệu Lý thuyết KHTH 8 (Chân trời sáng tạo) Bài 5: Mol và tỉ khối của chất khí. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết KHTH 8 (Chân trời sáng tạo) Bài 5: Mol và tỉ khối của chất khí
Bài giảng Bài 5: Mol và tỉ khối của chất khí
A. Kiến thức trọng tâm KHTN 8 Bài 5: Mol và tỉ khối của chất khí
I. Mol
Mol là lượng chất có chứa 6,022 × 1023 nguyên tử hay phân tử của chất đó.
Số 6,022 × 1023 gọi là số Avogadro và được kí hiệu là N.
Ví dụ:
1 mol nguyên tử Fe có chứa 6,022 × 1023 nguyên tử Fe.
1 mol phân tử NaCl có chứa 6,022 × 1023 phân tử NaCl.
II. Khối lượng mol
1. Khái niệm
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của 1 mol chất đó. Đơn vị khối lượng mol là gam/mol (hay gam.mol-1).
Ví dụ:
Khối lượng mol nguyên tử Cu là 64 gam/mol.
Khối lượng mol phân tử nước là 18 gam/mol.
2. Chuyển đổi giữa số mol và khối lượng
Gọi n là số mol chất (mol), M là khối lượng mol của chất (gam/mol) và m là khối lượng chất (gam), ta có công thức chuyển đổi sau:
![]()
III. Thể tích mol chất khí
1. Khái niệm
Một mol bất kì khí nào, trong cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau, người ta gọi đó là thể tích mol chất khí.
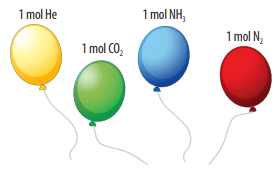
Định luật Avogadro: Trong cùng điều kiện nhiệt độ và áp suất, các khí có cùng thể tích sẽ chứa cùng số mol.
Ở điều kiện chuẩn (đkc) áp suất 1 bar, nhiệt độ 25oC thì 1 mol bất kì khí nào cũng đều chiếm thể tích 24,79 lít.
Ví dụ: Thể tích 1 mol khí O2 cũng như 1 mol khí N2 ở điều kiện chuẩn đều là 24,79 lít.
2. Chuyển đổi giữa số mol và thể tích
Gọi n là số mol chất khí (mol), V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau:
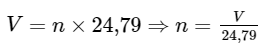
IV. Tỉ khối của chất khí
Tỉ khối của chất khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
![]()
Trong đó:
dA/B là tỉ khối của khí A đối với khí B.
MA, MB là khối lượng mol của khí A và khí B (gam/mol).
B. Bài tập KHTN 8 Bài 5: Mol và tỉ khối của chất khí
Đang cập nhật
Xem thêm các bài lý thuyết Khoa học tự nhiên 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học
Bài 6: Tính theo phương trình hoá học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.