Toptailieu.vn biên soạn và giới thiệu các kiến thức lý thuyết trọng tâm bao gồm định nghĩa, tính chất, ứng dụng và cách điều chế của anken trong bài viết dưới đây, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Nội dung bài viết
1. Định nghĩa Anken là gì?
Theo SGK Hóa học 11 (NXB Giáo dục Việt Nam) có định nghĩa rất rõ: “Anken là những hidrocacbon mạch hở mà trong phân tử có 1 liên kết đôi C=C”.
Anken (có tên gọi tiếng anh là alkene) là một loại hiđrocacbon không no thuộc hóa học hữu cơ chứa hai nguyên tố H và O trong phân tử.
Anken còn được gọi với một tên gọi khác là olefin ( từ được dùng trong công nghiệp hóa dầu ) hoặc cũng có thể gọi là vinyl.

2. Dãy đồng đẳng anken
Etilen (CH2 = CH2) và các chất tiếp theo có công thức phân tử C3H6, C4H8, C5H10,... có tính chất tương tự etilen lập thành dãy đồng đẳng có công thức phân tử chung CnH2n (n > 2) được gọi là anken hay olefin.
- CTTQ dãy đồng đẳng CnH2n(n 2)
- Tên gọi chung là anken hay olefin.
- Công thức đơn giản nhất là etilen (CH2=CH2).
- Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
- Trong phân tử có 1 liên kết đôi: gồm 1 liên kết σ và 1 liên kết π. Nguyên tử cacbon ở liên kết đôi tham gia 3 liên kết σ nhờ obitan lai hóa sp2, còn liên kết π nhờ obitan p không lai hóa.
- Đặc biệt phân tử CH2=CH2 có cấu trúc phẳng.
Dãy đồng đẳng của anken bao gồm:
3. Đồng phân
Tìm hiểu đồng phân anken chúng ta sẽ đi vào chi tiết đồng phân cấu tạo và đồng phân hình học của nó.
- Đồng phân cấu tạo: Etilen và propilen không có đồng phân anken. Từ C4H8 trở đi ứng với một công thức phân tử có các đồng phân anken về vị trí liên kết đôi và về mạch cacbon.
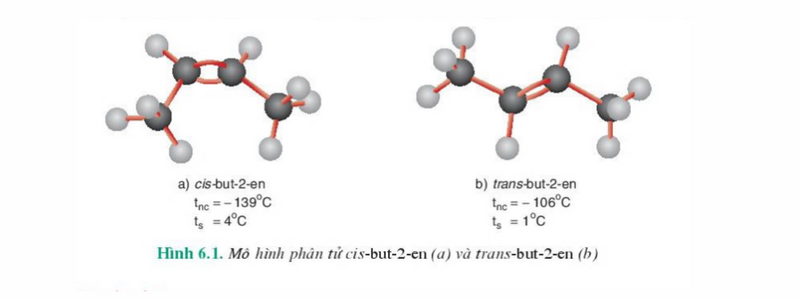
- Đồng phân hình học: Trong phân tử anken, mạch chính là mạch cacbon dài nhất có chứa liên kết đôi C=C. Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi liên với hai nhóm nguyên tử khác nhau sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi. Chính sự phân bố khác nhau đó tạo ra đồng phân về vị trí không gian của các nhóm nguyên tử gọi là đồng phân hình học.
+ Đồng phân cis: Đồng phân có mạch chính ở cùng một phía với liên kết C=C.
+ Đồng phân trans: Đồng phân có mạch chính ở về 2 phía khác nhau của liên kết C=C.
Ví dụ: Với công thức cấu tạo CH3-CH=CH-CH3 có các đồng phân hình học như hình bên dưới.
4. Danh pháp của anken
Cách gọi tên anken bao gồm tên thông thường và tên thay thế.
- Cách đọc tên anken thông thường: Được gọi bằng tên ankan nhưng thay đuôi “an” thành “ilen”. Ví dụ như etilen (C2H4), propilen (C3H6), butilen (C4H8).
- Tên thay thế của anken: Xuất phát từ tên ankan tương ứng bằng cách đổi đuôi “an” thành “en”. Từ CH4 trở đi, trong tên anken cần thêm số chỉ vị trí nguyên tử cacbon đầu tiên chứa liên kết đôi. Mạch cacbon được đánh số từ phía gần liên kết đôi hơn.
Quy tắc được tổng hợp như sau:
- Chọn mạch C dài nhất và có chứa liên kết đôi làm mạch chính.
- Đánh số C mạch chính từ phía có vị trí gần liên kết đôi nhất.
- Gọi tên theo thứ tự như sau: Số chỉ vị trí nhánh + Tên nhánh + Tên C mạch chính + Số chỉ liên kết đôi + en.
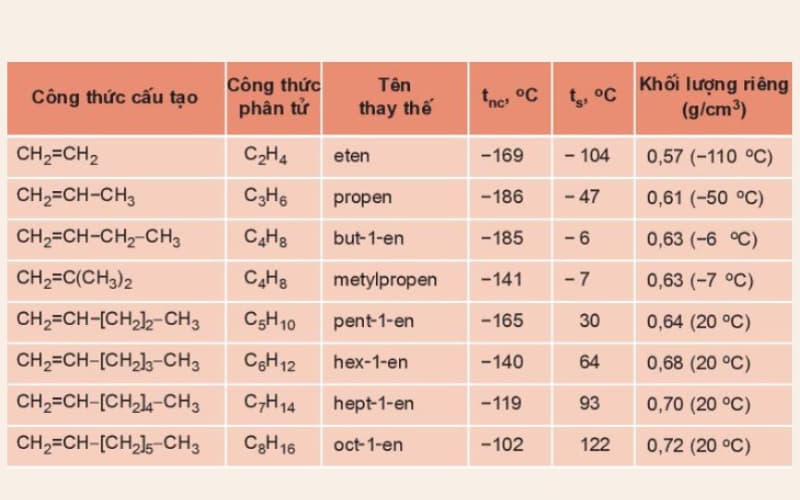
Bảng: Tên thay thế và một vài hằng số vật lý của một số anken
5. Tính chất vật lý của anken
Nhắc đến tính chất vật lý cả anken, chúng ta không thể bỏ qua một vài tính chất quan trọng sau:

Trong điều kiện thường, các anken từ C2H4 đến C4H8 là chất khí; từ C5H10 trở đi là chất rắn hoặc lỏng.
Nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng của anken tăng dần theo chiều tăng của phân tử khối.
Tất cả các anken đều nhẹ hơn nước (D <1g/cm3).
Anken không tan trong nước.
6. Tính chất hóa học của anken
Liên kết đôi C=C gồm liên kết σ và một liên kết π (liên kết π kém bền hơn liên kết σ) do vậy dễ dàng bị phân cắt hơn, gây nên tính chất hóa học đặc trưng của anken đó là dễ dàng tham gia phản ứng cộng tạo thành hợp chất no tương ứng.
Phản ứng cộng anken gồm phản ứng cộng hidro, phản ứng cộng halogen và phản ứng cộng HX.
- Phản ứng cộng hidro của anken: Khi đun nóng có kim loại niken (hoặc platin/ plaid) làm xúc tác, anken kết hợp với hidro tạo thành ankan tương ứng. Ví dụ: CH2=CH-CH3 + H2 → CH3-CH2-CH3 (Điều kiện: Ni, nhiệt độ)
- Phản ứng cộng halogen: Thực hiện thí nghiệm dẫn etilen từ từ đi vào dung dịch brom, thấy màu nâu đỏ của dung dịch bị nhạt dần. Ta có phương trình như sau: CH2=CH2 + Br2 (nâu đỏ) → CH2Br-CH2Br (1,2-đibrometan, không màu)
Tiếp tục thực hiện rót dung dịch brom vào cốc đựng anken (lỏng), quan sát thấy dung dịch brom bị mất màu. Ta có phương trình phản ứng như sau: CnH2n + Br2 → CnH2nBr2

- Phản ứng cộng HX: Các anken cũng tham gia vào phản ứng cộng với nước, hidro halogen (HBr, HCl, HI) và với các axit mạnh. Một số ví dụ minh họa: CH2=CH2 + H-OH → CH3-CH2-OH (Điều kiện H+) hoặc CH2=CH2 + H-Br → CH3-CH2-Br
Các Anken có cấu tạo phân tử không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp 2 sản phẩm. Ví dụ như:
CH3-CH=CH2 + HBr → CH3-CHBr-CH3 (2-brompropan – sản phẩm chính)
CH3-CH=CH2 + HBr → CH3-CH2-CH2Br (1-brompropan – sản phẩm phụ)
Quy tắc cộng HX hay còn được gọi là quy tắc Maccopnhicop (Markovnikov) sau:
Nguyên tử H sẽ gắn với nguyên tử cacbon bậc thấp, cụ thể là C ở liên kết đôi có nhiều H hơn.
Nhóm halide (X) sẽ gắn với nguyên tử cacbon bậc cao, cụ thể là C ở liên kết đôi có ít H hơn.
Sản phẩm chính của phản ứng chính là sản phẩm được tạo thành theo quy tắc Maccopnhicop.
Ở nhiệt độ và áp suất cao với chất xúc tác thích hợp, các phân tử anken có thể kết hợp với nhau tạo thành những mạch rất dài và có phân tử khối lớn.
Ví dụ:
… + CH2=CH2+CH2=CH2+CH2=CH2+…→… -CH2-CH2-CH2-CH2-CH2-CH2-… (Điều kiện: Nhiệt độ, p, xúc tác)
Phương trình thu gọn như sau:
nCH2=CH2 → (-CH2–CH2-)n (Polietylen hay PE)
Phản ứng trùng hợp thuộc loại phản ứng polime hóa, là quá trình liên kết nhiều phân tử nhỏ giống nhau hoặc tương tự nhau để tạo thành những phân tử rất lớn, gọi là polime. Trong đó:
Chất đầu (CH2 = CH2) là monome.
-CH2 – CH2– là mắc xích của polime.
n là hệ số trùng hợp.
Phản ứng oxi hóa hoàn toàn và phản ứng oxi hóa không hoàn toàn cũng là một trong những tính chất hóa học quan trọng của anken.
Khi bị đốt với oxi, etilen và các đồng đẳng sẽ bị cháy và tỏa ra nhiệt.
CnH2n + 3n/2 O2 → nCO2 + nH2O
Để làm rõ phản ứng oxi hóa không hoàn toàn của anken, ta thực hiện thí nghiệm sục khí etilen vào dung dịch KMnO4. Quan sát thấy màu của dung dịch sẽ nhạt dần và có kết tủa màu nâu đen của MnO2.
Ta có phản ứng như sau:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MNO4 (kết tủa) + 2KOH
Cách điều chế anken trong phòng thí nghiệm và sản xuất trong công nghiệp có sự khác biệt.
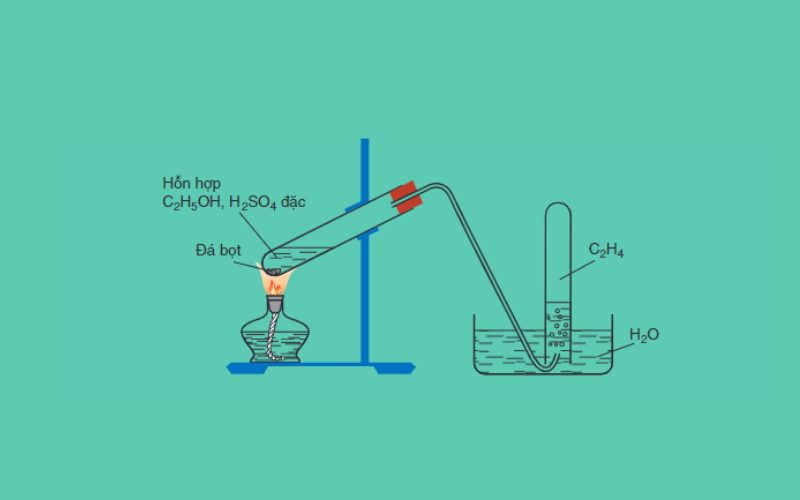
Trong phòng thí nghiệm, etilen được điều chế từ ancol etylen
C2H5OH → CH2=CH2 + H2O (Điều kiện: H2SO4 đặc, 170 độ C)
Trong công nghiệp, anken được điều chế từ ankan:
CnH2n+2 → CnH2n + H2 (Điều kiện: Nhiệt độ, p, xúc tác)
Các anken và dẫn xuất của anken là nguyên liệu cho quá trình sản xuất hóa học. Một số ứng dụng quan trọng của
anken là:
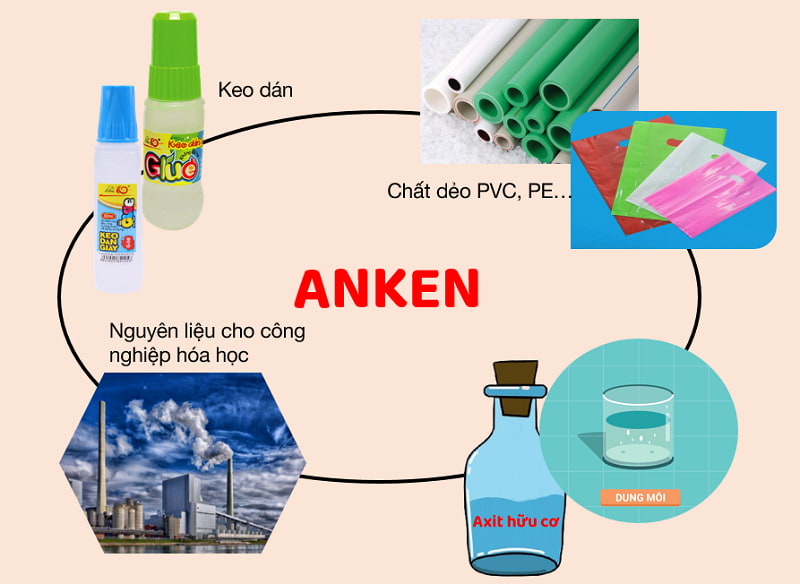
Sử dụng trong chế tạo màng mỏng, ống dẫn nước, bình chứa… bằng cách trùng hợp etilen, propilen, butilen… thu được polime.
Anken cũng được ứng dụng trong sản xuất rượu, dẫn xuất halogen hay một số chất khác.
Monome được chuyển hóa từ Etilen để tổng hợp hàng loạt polime đáp ứng nhu cầu phong phú của đời sống, kỹ thuật.
9. Sơ đồ tư duy: Anken
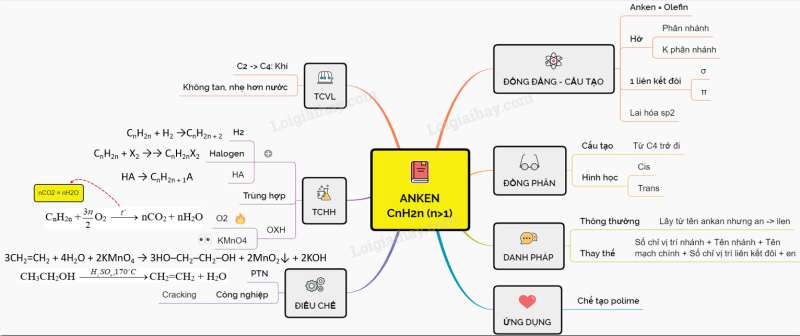
10. Phân biệt anken và ankan
Để phân biệt anken và ankan, ta sử dụng dung dịch brom. Khi rót brom vào cốc đựng anken (lỏng) sẽ thấy dung dịch brom bị mất màu trong khi đó ankan thì không làm mất màu dung dịch brom.
Ngoài brom, chúng ta cũng có thể sử dụng thuốc tím (KMnO4) để nhận biết anken. Anken làm mất màu dung dịch thuốc tím nên dễ dạng để nhận biết.
Xem thêm các chất hữu cơ chi tiết khác:
Ankan: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
Ankin: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
Ankadien: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
Ancol: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
Benzen: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.