Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Cánh diều) Bài 4: Đơn chất nitrogen hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
SBT Hóa 11 (Cánh diều) Bài 4: Đơn chất nitrogen
Bài 4.1 trang 14 SBT Hoá học 11: Phát biểu nào sau đây về nguyên tố nitrogen (7N) là không đúng?
A. Nguyên tử nguyên tố nitrogen có cấu hình electron là ls22s22p3.
B. Nguyên tử nguyên tố nitrogen có 3 electron hoá trị.
C. Nguyên tố nitrogen thuộc chu kì 2, nhóm VA trong bảng tuần hoàn.
D. Trong một số hợp chất, nguyên tử nitrogen có thể dùng cặp electron hoá trị riêng để tạo một liên kết cho – nhận với nguyên tử khác.
Lời giải:
Đáp án đúng là: B
Nguyên tử nguyên tố nitrogen có 5 electron hoá trị.
A. +5 và V. B. +5 và IV. C. +5 và III. D. +4 và IV.
Lời giải:
Đáp án đúng là: B
Công thức cấu tạo của HNO3 là:
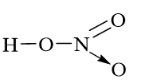
Vậy N có cộng hóa trị là 4. Số oxi hóa của N là +5 do trong HNO3 số oxi hóa của H là +1 và O là –2.
Bài 4.3 trang 14 SBT Hoá học 11: Phát biểu nào sau đây về đon chất nitrogen (N2) là không đúng?
A. Dù phân tử N2 có tính kém hoạt động hoá học, nhưng vẫn hoạt động hoá học mạnh hơn chlorine, Cl2.
B. Đơn chất nitrogen không phản ứng với hydrogen, oxygen ở điều kiện thường.
c. Do có nhiệt độ rất thấp nên nitrogen lỏng được sử dụng bảo quản một số
loại mẫu vật.
D. Trong bầu khí quyển, khi có sấm chớp, khí nitrogen tạo các nitrogen oxide, là một nguyên nhân làm cho nước mưa có tính acid.
Lời giải:
Đáp án đúng là: A
Phân tử N2 không hoạt động hóa học tốt hơn Cl2 do năng lượng liên kết của N2 lớn hơn nhiều so với Cl2.
Đọc đoạn thông tin trên và trả lời các câu hỏi dưới đây bằng cách chọn phương án đúng:
a) Vai trò của khí nitrogen trong hệ phản ứng trên là gì?
A. Tạo môi trường trơ.
B. Là chất tham gia phản ứng.
C. Giữ nhiệt độ phản ứng cố định.
D. Hạn chế sự bay hơi của dung môi hữu cơ.
b) Có thể thay khí nitrogen bằng loại khí nào sau đây?
A. Các khí có chứa nguyên tố nitrogen vì nitrogen cần cho phản ứng.
B. Hơi nước vì hơi nước giúp ổn định nhiệt độ và không độc hại.
C. Argon, neon,… hoặc các khí trơ khác.
D. Các khí có tỉ trọng lớn để ngăn dung môi hữu cơ bay hơi.
c) Vì sao bẫy dung môi cần được ngâm trong nitrogen lỏng?
A. Do nhiệt độ nitrogen lỏng rất thấp.
B. Do phản ứng cần môi trường trơ.
C. Để hạ nhiệt độ phản ứng làm mát bơm.
D. Vì nitrogen lỏng có thể phản ứng với dung môi hữu cơ tạo chất ít độc hại.
d) Từ tìm hiểu, tra cứu nhiệt độ nóng chảy và nhiệt độ sôi của một số dung môi hữu cơ thông dụng, dự đoán dung môi hữu cơ được giữ lại trong bẫy dung môi dưới dạng nào sau đây.
A. Khí. B. Lỏng. C. Rắn. D. Lỏng hoặc rắn.
e) Vì sao có sự xuất hiện của oxygen lỏng trong trong bẫy dung môi?
A. Oxygen có sẵn trong hệ khi rút ra sẽ hoá lỏng khi đi qua bẫy dung môi.
B. Nhiệt độ nóng chảy của oxygen cao hơn nhiệt độ nitrogen lỏng.
C. Oxygen được sinh ra trong phản ứng tổng hợp.
D. Oxygen có thể đi vào hệ thông qua các kẽ hở.
g) Nguyên nhân gây nổ được xác định là do oxygen lỏng. Để hạn chế việc này xảy ra người ta đã thiết kế, cải tiến bẫy dung môi bằng chất liệu phù hợp. Theo em, nên chọn loại vật liệu nào sau đây?
A. Loại thép dày, nếu vụ nổ có xảy ra cũng không thể phá huỷ, không gây nguy hiểm cho người sử dụng.
B. Vật liệu chống cháy, vụ nổ có thể tạo ra nhiều nhiệt do đó cần vật liệu cách nhiệt để tránh hơi nóng thoát ra gây hoả hoạn.
C. Thuỷ tinh cách nhiệt, trong suốt giúp quan sát phát hiện màu xanh của oxygen lỏng, đồng thời ngăn nhiệt thoát ra ngoài.
D. Thuỷ tinh chịu nhiệt, trong suốt giúp phát hiện lượng oxygen lỏng xuất hiện (nếu có) và xử lí sớm, do oxygen lỏng có màu xanh.
Lời giải:
Đáp án đúng là: a) A; b) C; c) A; d) C; e) A; g) D.
Bài 4.5 trang 16 SBT Hoá học 11: Cho hai phương trình hoá học sau:
N2(g) + O2(g) → 2NO(g) ΔrHo298 = 180kJ (1)
2NO(g) + O2(g) → 2NO2(g) ΔrHo298 = -114kJ (2)
Những phát biểu nào sau đây về hai phương trình hoá học trên là đúng?
(a) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng toả nhiệt.
(b) Phản ứng (2) tạo NO2 từ NO, là quá trình thuận lợi về mặt năng lượng. Điều này cũng phù hợp với thực tế là khí NO (không màu) nhanh chóng bị oxi hoá thành khí NO2 (màu nâu đỏ).
(c) Enthalpy tạo thành chuẩn của NO2 là 80 kJ mol–1.
(d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1) và năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ mol–1 và 946 kJ mol–1, tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện là 632 kJ mol–1.
Lời giải:
Đáp án đúng là: (a), (b), (d).
Do phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng toả nhiệt nên phản ứng (2) là quá trình thuận lợi về mặt năng lượng.
Lời giải:
Đáp án đúng là:
Dựa trên tính chất là khí nitrogen không duy trì sự cháy, gần như trơ ở nhiệt độ thường và nhiệt độ không quá cao (chỉ hoạt động ở nhiệt độ rất cao) nên nitrogen được dùng trong phòng cháy, chữa cháy; bảo quản thực phẩm, ngăn thực phẩm bị oxi hoá nhanh hỏng; ngăn ethanol trong bia bị oxi hoá thành acid gây ra vị chua. Nitrogen lỏng có nhiệt độ rất thấp −196oC. Ngoài giúp trữ đông mô, việc đưa một lượng khí nitrogen ở nhiệt độ rất thấp vào mô ung thư có thể làm đông đặc mô bệnh, sau đó rã đông, quá trình lặp lại nhiều lần mô bệnh sẽ chết và được loại bỏ; phương pháp này ít gây đau đớn và ít mất máu cho bệnh nhân hơn so với phẫu thuật truyền thống.
|
Liên kết |
H−H |
N−H |
N≡N |
|
Năng lượng liên kết (kJ mol–1) |
436 |
389 |
946 |
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết:
Lời giải:
a) ΔrHo298 = 1.946 + 3.436 – 6.389 = −80 (kJ).
b) Với kết quả tính được từ a) thì enthalpy tạo thành chuẩn của ammonia là –40 kJ mol–1.
c) Giá trị enthalpy tạo thành chuẩn tính theo năng lượng liên kết thường khác biệt nhiều với giá trị thực nghiệm. Đó là do giá trị năng lượng của một liên kết cộng hoá trị giữa A và B thường chỉ là giá trị năng lượng liên kết trung bình của các liên kết giữa A và B trong nhiều hợp chất khác nhau. Trong bài tập này, giá trị 389 kJ mol–1 được hiểu là giá trị trung bình năng lượng liên kết N và H trong nhiều hợp chất khác nhau, như NH3, CH3–NH2,…
Xem thêm Lời giải các bài SBT Hoá 11 Cánh Diều hay, chi tiết khác:
Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 3: PH của dung dịch. Chuẩn độ acid – base
Bài 5: Một số hợp chất quan trọng của nitrogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.