Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Cánh diều) Bài 12: Alkane hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
SBT Hóa 11 (Cánh diều) Bài 12: Alkane
Bài 12.1 trang 38 SBT Hóa học 11: Phát biểu nào sau đây là đúng?
A. Những hợp chất mà trong phân tử chỉ có liên kết đơn là hydrocarbon no.
B. Hydrocarbon chỉ có liên kết đơn trong phân tử là hydrocarbon no.
C. Hydrocarbon có các liên kết đơn trong phân tử là hydrocarbon no.
D. Hydrocarbon có ít nhất một liên kết đơn trong phân tử là hydrocarbon no.
Lời giải:
Đáp án đúng là: B
Hydrocarbon chỉ có liên kết đơn trong phân tử là hydrocarbon no.
Bài 12.2 trang 38 SBT Hóa học 11: Phát biểu nào sau đây về alkane là không đúng?
A. Trong phân tử alkane chỉ có liên kết đơn.
B. Chỉ các alkane là chất khí ở điều kiện thường được dùng làm nhiên liệu.
C. Các alkane lỏng được dùng sản xuất xăng, dầu và làm dung môi.
D. Các alkane rắn được dùng làm nhựa đường, nguyên liệu cho quá trình cracking.
E. Công thức chung của alkane là CxH2x+2, với x ≥ 1.
Lời giải:
Đáp án đúng là: B
Một số alkane lỏng, rắn cũng có thể được sử dụng làm nhiên liệu.
Bài 12.3 trang 38 SBT Hóa học 11: Số đồng phân cấu tạo ứng với công thức phân tử C6H14 là
A. 3. B. 5. C. 4. D. 6.
Lời giải:
Đáp án đúng là: B
5 đồng phân của C6H14 là
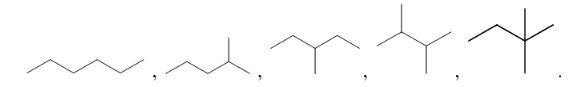
A. 2,2-dimethylpentane. B. 2,3-dimethylpentane.
C. 2,2,3-trimethylbutane. D. 2,2-dimethylbutane.
Lời giải:
Đáp án đúng là: A
(CH3)3CCH2CH2CH3: 2,2-dimethylpentane.
(a) Phân tử khối. (b) Tương tác van der Waals giữa các phân tử.
(c) Độ tan trong nước. (d) Liên kết hydrogen giữa các phân tử.
Lời giải:
Đáp án đúng là: (c), (d).
Do không có liên kết hydrogen hình thành giữa các phân tử alkane nên độ tan trong nước và liên kết hydrogen không ảnh hưởng đến nhiệt độ sôi các alkane.
A. 3. B. 4. C. 2. D. 5.
Lời giải:
Đáp án đúng là: C
2 alkene đồng phân cấu tạo của nhau là: 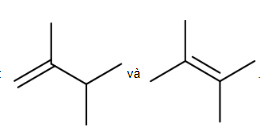
A. Ethane. B. Propane. C. Pentane. D. Butane.
Lời giải:
Đáp án đúng là: A
Nhiệt lượng khi đốt cháy 1 gam các hydrocarbon lần lượt là
Ethane: 130. 1 570 = 52,33 (kJ).
Propane: 144.2 220 = 50,45 (kJ).
Butane: 158. 2 875 = 49,57 (kJ).
Pentane: 172. 3 536 = 49,11 (kJ).
Vậy ethane tỏa ra nhiều nhiệt lượng nhất.
A. trong ống nghiệm có chất lỏng đồng nhất.
B. màu của nước bromine bị mất.
C. màu của bromine không thay đổi.
D. trong ống nghiệm xuất hiện kết tủa.
Lời giải:
Đáp án đúng là: B
Do xảy ra phản ứng thế của hexane với bromine nên màu của nước bromine bị mất.
A. 3. B. 4. C. 5. D. 6.
Lời giải:
Đáp án đúng là: B
Bromine có thể thế vào 4 vị trí của hydrocarbon Y như đánh số sau:
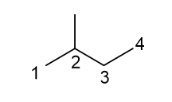
Vậy sẽ có 4 dẫn xuất monobromo là đồng phân cấu tạo của nhau.
A. CH4. B. C2H4. C. C2H6. D. C6H6.
Lời giải:
Đáp án đúng là: A
Gọi công thức của hydrocarbon X là CxHy. Ta có:
x : y = 7512:251 = 6.25 : 25 = 1 : 4
Vậy công thức phân tử của X là CH4.
Bài 12.11 trang 39 SBT Hóa học 11: Cho butane phản ứng với chlorine thu được sản phẩm chính là
A. 2-chlorobutane. B. 1-chlorobutane.
C. 3-chlorobutane. D. 4-chlorobutane.
Lời giải:
Đáp án đúng là: A
Trong phản ứng thế halogen, nguyên tử H ở carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử H ở carbon bậc thấp.
A. Thực hiện phản ứng reforming để thay đổi cấu trúc của các alkane mạch không nhánh thành hydrocarbon mạch nhánh hoặc mạch vòng có chỉ số octane cao.
B. Thực hiện phản ứng cracking để thay đổi cấu trúc các alkane mạch dài chuyển thành các alkene và alkane mạch ngắn hơn.
C. Thực hiện phản ứng hydrogen hoá để chuyển các alkene thành alkane.
D. Bổ sung thêm heptane vào xăng, dầu.
Lời giải:
Đáp án đúng là: A
Phản ứng reforming tạo nhiều hydrocarbon mạch nhánh, làm tăng chỉ số octane của xăng, dầu. Xăng, dầu có chỉ số octane càng cao thì càng có hiệu suất cháy cao, đồng thời giảm thiểu được ô nhiễm môi trường.
A. Không sử dụng phương tiện giao thông.
B. Cấm các phương tiện giao thông tại các đô thị.
C. Sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
D. Sử dụng các phương tiện chạy bằng than đá.
Lời giải:
Đáp án đúng là: C
Sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
Bài 12.14 trang 40 SBT Hóa học 11: Trong công nghiệp, các alkane được điều chế từ nguồn nào sau đây?
A. Sodium acetate. B. Dầu mỏ và khí mỏ dầu.
C. Aluminium carbide (Al4C3). D. Khí biogas.
Lời giải:
Đáp án đúng là: B
Alkane dùng trong công nghiệp được lấy từ nguồn alkane có trong tự nhiên, bao gồm dầu mỏ, khí thiên nhiên và khí mỏ dầu.
Lời giải:
Do tính phản ứng chọn lọc của bromine nên sản phẩm chính là chất có nguyên tử Br ở nguyên tử carbon có bậc cao nhất: (CH3)2CBrCH2CH3.
Lời giải:
Các hợp chất có thể thu được là:
CH2=C(CH3)CH2CH3, (CH3)2C=CHCH3, (CH3)2CHCH=CH2.
a) Các sự cố tràn dầu trên biển gây ra các thảm hoạ về môi trường như thế nào?
b) Để xử lí sự cố tràn dầu trên biển, người ta thường làm như thế nào?
Giải thích lí do sử dụng các kĩ thuật đó.
Lời giải:
a) Dầu nhẹ hơn nước, không tan trong nước, bị loang ra nên che phủ bề mặt biển làm giảm khả năng hoà tan của oxygen trong không khí vào trong nước biển, làm cho các sinh vật biển bị chết…
b)
Để xử lí sự cố tràn dầu trên biển, người ta thường:
- Dùng các phao để gom dầu; việc dùng vật liệu hấp phụ dầu hiện đang nghiên cứu triển khai.
- Hút dầu vào các bể chứa (lẫn nước biển).
- Chiết tách để loại bỏ nước, thu lấy dầu.
Lời giải:
Phương án 1. Khai thác như khai thác than: đào mỏ; lấy các cục băng cháy, làm tan chảy thu lấy khí methane.
Phương án 2. Như kĩ thuật hiện đại khai thác sulfur: làm tan chảy băng cháy dưới lòng đất, thu khí bay lên.
Lời giải:
Nếu chỉ dùng một loại hydrocarbon thì nhiệt giải phóng ra không đủ để khởi động động cơ. Và việc lưu trữ để đủ lượng xăng cho ô tô, xe máy sẽ khó khăn hơn (bình rất to hoặc phải là bình chịu áp suất cao).
|
Chất |
Nhiệt lượng (kJ mol−1) |
Chất |
Nhiệt lượng (kJ mol−1) |
|
methane |
783 |
propane |
2 220 |
|
ethane |
1 570 |
butane |
2 875 |
a) Khi đốt 1 gam chất nào sẽ giải phóng ra lượng nhiệt lớn nhất?
b) Để đun sôi cùng một lượng nước từ cùng nhiệt độ ban đầu, với giả thiết các điều kiện khác là như nhau, cần đốt cháy khối lượng chất nào là ít nhất?
Lời giải:
a) Tính lượng nhiệt tỏa ra khi đốt cháy 1 gam chất.
|
Chất |
Nhiệt lượng (kJ mol−1) |
Nhiệt lượng/gam (kJ mol−1g−1) |
Chất |
Nhiệt lượng (kJ mol−1) |
Nhiệt lượng/gam (kJ mol−1g−1) |
|
methane |
783 |
48,94 |
propane |
2 220 |
50,45 |
|
ethane |
1 570 |
52,33 |
butane |
2 875 |
46,57 |
Như vậy, khi đốt cháy 1 gam mỗi chất trên, ethane sẽ sinh ra lượng nhiệt lớn nhất.
b) Từ kết quả phần a), ta thấy khối lượng chất cần đốt cháy ít nhất là ethane.
Lời giải:
Trong 1 lít khí gas có 0,4 lít propane (số mol = 0,0161 mol) và 0,6 lít butane (số mol = 0,0242).
Lượng nhiệt toả ra tương ứng:
0,0161.2 220 + 0,0242.2 875 = 35,742 + 69,575 = 105,317 (kJ).
Lời giải:
Khi phát hiện rò rỉ khí gas trong nhà, chúng ta cần:
- Làm thoáng không khí trong phòng bằng cách mở cửa.
- Không được bật các thiết bị điện như quạt, đèn,…
- Kiểm tra khoá bình gas, khoá lại nếu do quên chưa khóa.
- Báo cho nhà cung cấp gas để sửa chữa, thay thế nếu do van bị hỏng hoặc ống dẫn gas bị hở (do lâu ngày nên bị nứt, do chuột cắn,…).
Lời giải:
Do các phương tiện giao thông đốt cháy nhiên liệu sinh ra nhiều khí carbon dioxide, các nitrogen oxide, carbon monoxide và các hạt bụi mịn do xăng, dầu cháy không hoàn toàn… nên có thể nói “Các phương tiện giao thông là một trong các nguyên nhân chính gây ra ô nhiễm môi trường ở các đô thị lớn”.
Xem thêm Lời giải các bài SBT Hoá 11 Cánh Diều hay, chi tiết khác:
Bài 10: Công thức phân tử hợp chất hữu cơ
Bài 11: Cấu tạo hoá học của hợp chất hữu cơ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.