Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Kết nối tri thức) Bài 4: Nitrogen hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
SBT Hóa 11 (Kết nối tri thức) Bài 4: Nitrogen
Bài 4.1 trang 15 SBT Hóa 11: Khí nào phổ biến nhất trong khí quyển Trái Đất?
A. Oxygen.
B. Nitrogen.
C. Ozone.
D. Argon.
Lời giải:
Đáp án đúng là: B
Khí phổ biến nhất trong khí quyển Trái Đất là khí nitrogen (chiếm 78%).
Bài 4.2 trang 15 SBT Hóa 11: Công thức hoá học của diêm tiêu Chile là
A. Ca(NO3)2.
B. NH4NO3.
C. NH4Cl.
D. NaNO3.
Lời giải:
Đáp án đúng là: D
Công thức hoá học của diêm tiêu Chile là NaNO3.
Bài 4.3 trang 15 SBT Hóa 11: Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là
A. chu kì 2, nhóm VA.
B. chu kì 3, nhóm VA.
C. chu kì 2, nhóm VIA.
D. chu kì 3, nhóm IVA.
Lời giải:
Đáp án đúng là: A
Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là chu kì 2, nhóm VA.
A. Tinh bột.
B. Cellulose.
C. Protein.
D. Glucose.
Lời giải:
Đáp án đúng là: C
Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ là protein.
Bài 4.5 trang 15 SBT Hóa 11: Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là
A. 0 và +5.
B. -3 và 0.
C. -3 và +5.
D. -2 và +4.
Lời giải:
Đáp án đúng là: C
Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là -3 và +5.
A. 14N
B. 13N
C. 15N.
D. 12N.
Lời giải:
Đáp án đúng là: A
Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị 14 N.
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
Lời giải:
Đáp án đúng là: B
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là chất oxi hóa (số oxi hóa giảm từ 0 → -3)
0N2+3H2t∘,p⇌xt2−3NH3
A. NO.
B. N2O.
C. NH3.
D. NO2.
Lời giải:
Đáp án đúng là: A
Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là NO.
N2+O2hν⇌2NO
Bài 4.9 trang 16 SBT Hóa 11: Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là
A. chất oxi hoá.
B. base.
C. chất khử.
D. acid.
Lời giải:
Đáp án đúng là: C
Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là chất khử (vì số oxi hóa tăng từ 0 → +2.
0N2+O2hν⇌2+2NO
A. Phân kali.
B. Phân đạm ammonium,
C. Phân lân.
D. Phân đạm nitrate.
Lời giải:
Đáp án đúng là: D
Trong tự nhiên, phản ứng giữa nitrogen và oxygen (trong con mưa dông kèm sấm sét) là khởi đầu cho quá trình tạo và cung cấp loại phân đạm nitrate cho cây.
Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa được biểu diễn theo sơ đồ:
N2+O2→NO+O2→NO2+O2+H2O→HNO3→H++NO−3
Bài 4.11 trang 16 SBT Hóa 11: Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar.
B. 0,01 bar.
C. 0,78 bar.
D. 0,28 bar.
Lời giải:
Đáp án đúng là: C
Do N2 chiếm 78% trong khí quyển và áp suất khí quyển được quy định là 1 bar nên áp suất riêng phần của khí nitrogen trong khí quyển là 0,78 bar.
A. 14,000.
B. 14,004.
C. 14,037.
D. 14,063.
Lời giải:
Đáp án đúng là: B
Nguyên tứ khối trung bình của nitrogen là 14.99,63+15.0,37100=14,0037≈14,004
Bài 4.13 trang 16 SBT Hóa 11: Số liên kết sigma và số liên kết pi trong phân tử nitrogen lần lượt là
A. 2 và 1
B. 0 và 3.
C. 3 và 0.
D. 1 và 2.
Lời giải:
Đáp án đúng là: D
Phân tử nitrogen có liên kết 3 (N ≡ N), gồm 1 liên kết (σ) bền và 2 liên kết (π) kém bền.
A. 2 và 418 kJ/mol.
B. 1 và 167 kJ/mol.
C. 1 và 386 kJ/mol.
D. 3 và 945 kJ/mol.
Lời giải:
Đáp án đúng là: D
Bậc liên kết và năng lượng liên kết trong phân tử nitrogen tương ứng là 3 và 945 kJ/mol.
Bài 4.15 trang 16 SBT Hóa 11: Nitrogen thể hiện tính khử trong phản ứng nào sau đây?
A. N2+O2t∘⇌2NO
B. N2+3H2t∘,p⇌xt2NH3
C. 3Ca+N2t∘→Ca3 N2
D. 3Mg+N2t∘→Mg3 N2
Lời giải:
Đáp án đúng là: A
Nitrogen thể hiện tính khử trong phản ứng N2+O2t∘⇌2NO vì số oxi hóa của N tăng từ 0 → +2.
Bài 4.16 trang 16 SBT Hóa 11: Nhận định nào sau đây về phân tử nitrogen là đúng?
A. Có ba liên kết đơn bền vững.
B. Chứa nguyên tử nitrogen có số oxi hoá là -3.
C. Có liên kết cộng hoá trị có cực.
D. Thể hiện cả tính oxi hoá và tính khử.
Lời giải:
Đáp án đúng là: D
Nhận định đúng về phân tử nitrogen là: “Thể hiện cả tính oxi hoá và tính khử” vì phân tử nitrogen có số oxi hóa là 0, nên có thể cho electron (lên số oxi hóa +3, +5) hoặc nhận electron (giảm về số oxi hóa -3).
Bài 4.17 trang 17 SBT Hóa 11: Nhận định nào sau đây về đơn chất nitrogen là sai?
A. Không màu và nhẹ hơn không khí.
B. Hoá hợp với oxygen ở nhiệt độ cao hoặc tia lửa điện.
C. Thể hiện tính oxi hoá mạnh ở điều kiện thường.
D. Khó hoá lỏng và ít tan trong nước.
Lời giải:
Đáp án đúng là: C
Nhận định sai về đơn chất nitrogen là thể hiện tính oxi hoá mạnh ở điều kiện thường.
Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ. Vì vậy, ở nhiệt độ và áp suất thường nitrogen rất khó tham gia các phản ứng hóa học.
A. Nitrogen có tính oxi hoá mạnh.
B. Nitrogen rất bền với nhiệt.
C. Nitrogen khó hoá lỏng.
D. Nitrogen không có cực.
Lời giải:
Đáp án đúng là: B
Trong nghiên cứu, khí nitrogen thường được dùng để tạo bầu khí quyển trơ dựa trên cơ sở là nitrogen rất bền với nhiệt do năng lượng liên kết trong phân tử liên kết 3 khá lớn (946 kJ/mol).
Bài 4.19 trang 17 SBT Hóa 11: Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
N2+O2→NO+O2→NO2+O2+H2O→HNO3→NO−3
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3.
B. 1.
C. 4.
D. 2.
Lời giải:
Đáp án đúng là: A
Gồm các phản ứng sau:Lời giải:
Phân tử khối trung bình của không khí là
¯Mkk=28,014.0,78+31,998.0,21+39,948.0,01=28,970
Hoặc ¯Mkk=28,014.78+31,998.21+39,948.1100=28,970
Giá trị phân tử khối trung bình của không khí thường lấy bằng 29.
Lời giải:
Ở bài trên ta tính được phân tử khối trung bình của không khí là ¯Mkk=28,970
Ở điều kiện chuẩn, 1 mol không khí nặng 28,97 g và chiếm thể tích 24,79 L.
D=mV=28,97024,79=1,169 (g/L)
Bài 4.22 trang 17 SBT Hóa 11: Trong công nghiệp, ammonia được sản xuất theo phản ứng pha khí:
N2( g)+3H2( g)to,xt⇌2NH3( g)S
Cho biết các giá trị năng lượng liên kết :
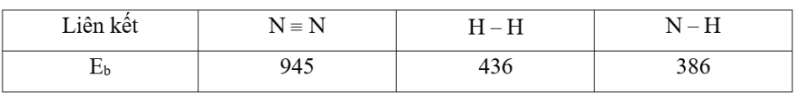
a) Tính nhiệt phản ứng ΔrH∘ của phản ứng ở điều kiện chuẩn, nhận xét về dấu và độ lớn của giá trị tìm được.
b) Tính nhiệt tạo thành ΔfH0( kJ⋅mol−1) của NH3 (k).
Lời giải:
a) ΔHor=942.1+432.3−386.6=−78 (kJ)
b) Nhiệt tạo thành của NH3(g) là biến thiên enthalpy của phản ứng:
12N2(g)+32H2(g)→NH3(g) ΔfHo
ΔfHo=ΔrHo2=−782=−39 (kJ/mol)
Lời giải:
Giả thiết số mol ban đầu: N2 = 1 mol, H2 = 3 mol.
=> Tổng số mol khí ban đầu là 4 mol
N2(g) + 3H2(g) ⇌ 2NH3(g)
Ban đầu: 1 3 (mol)
Phản ứng: x 3x 2x (mol)
Cân bằng: 1-x 3-3x 2x (mol)
Tổng số mol khí sau phản ứng là 1 – x + 3 - 3x + 2x = 4 - 2x
Số mol khí giảm so với ban đầu là 2x
Ta có:
Bài 4.24 trang 17 SBT Hóa 11: Cho cân bằng ở 1650oC:
Thực hiện phản ứng trên với một hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 4 : 1. Tính hiệu suất của phản ứng khi hệ cân bằng ở 1650oC.
Lời giải:
Giả sử số mol ban đầu:
Ban đầu: 4 1 (mol)
Cân bằng: 4 - x 1 - x 2x (mol)
Cho biết nhiệt độ sôi nitrogen, hydrogen và ammonia lần lượt là -196oC, -253 oC và -33oC.
Đề xuất phương pháp vật lí tách ammonia khơi hỗn hợp đó.
Lời giải:
Từ dữ kiện về nhiệt độ sôi cho thấy ammonia lỏng có nhiệt độ sôi cao nhất, ngược lại khí ammonia sẽ dễ bị hóa lỏng nhất.
Như vậy, nếu giảm nhiệt độ hỗn hợp xuống thấp hơn -33oC vài độ, ví dụ ở -40oC thì toàn bộ khí ammonia sẽ hóa lỏng và được tách ra. Trong khi đó, ở -40oC thì nitrogen và hydrogen vẫn ở trạng thái khí được dẫn về thực hiện vòng tuần hoàn mới.
Xem thêm các bài giải SBT hoá học 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.