Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Chân trời sáng tạo) Bài 13: Hydrocarbon không no hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi vở bài tập Hóa 11 Bài 13 từ đó học tốt môn Hóa 11.
Nội dung bài viết
SBT Hóa 11 (Chân trời sáng tạo) Bài 13: Hydrocarbon không no
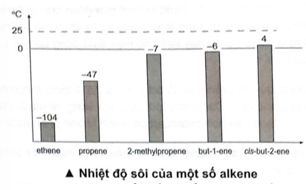
Có bao nhiêu alkene trong biểu đồ ở thể khí trong điều kiện thường (25 °C)?
A. 4.
B. 2.
C. 3.
D. 5.
Lời giải:
Trên đồ thị, ta thấy có 5 alkene có nhiệt độ sôi nhỏ hơn nhiệt độ phòng (25 oC). Do đó, 5 alkene này ở thể khí trong điều kiện thường.
→ Chọn D.
Lời giải:
Các đồng phân cấu tạo của alkyne C5H8
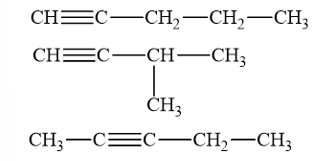
→ Chọn A.
Bài 13.3 trang 56 SBT Hóa học 11: Cho các alkene sau:
Số alkene có đồng phân hình học là
Lời giải:
Trong phân tử của hai alkene CH2=CH-CH2-CH3, (CH3)2C=C(CH3)2, ta thấy nguyên tử C trong liên kết đôi liên kết với hai nhóm thế giống nhau nên chúng không có đồng phân hình học.
Trong phân tử của hai alkene CH3-CH2-CH=CH-CH3, CH3-CH2-CH=CH-CH2-CH3, ta thấy nguyên tử C trong liên kết đôi liên kết với hai nhóm thế khác nhau nên chúng có đồng phân hình học.
→ Chọn B.
Bài 13.4 trang 56 SBT Hóa học 11: Viết công thức khung phân tử của
Lời giải:
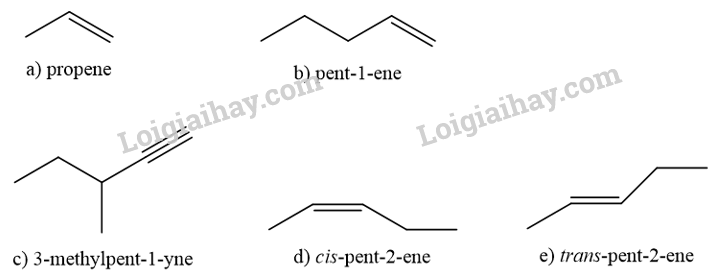
Bài 13.5 trang 57 SBT Hóa học 11: Cho các phân tử alkene có công thức khung phân tử dưới đây
a) Gọi tên các phân tử alkene nêu trên theo danh pháp thay thế.
b) So sánh tương tác van der Waals giữa các phân tử alkene nếu trên. Từ đó em có kết luận gì?
Lời giải:
a) (A): propene.
(B): but-1-ene.
(C): pent -1-ene.
b) Đi từ propene đến pent-1-ene, kích thước phân tử alkene tăng dần làm cho diện tích bề mặt tiếp xúc giữa chúng cũng tăng, tương tác van der Waals giữa các phân tử do đó cũng tăng dần, dẫn đến nhiệt độ sôi các alkene tăng dần. Ngoài ra, ở điều kiện thường, propene và but-1-ene là các chất khí trong khi pent-1-ene là chất lỏng vì tương tác van der Waals giữa các phân tử propene và but-1-ene chưa đủ lớn. Các phân tử alkene có từ 18 nguyên tử carbon trở lên ở thể rắn, do tương tác van der Waals giữa chúng là mạnh đáng kể.
Lời giải:
- Công thức cấu tạo của alkene C5H10:
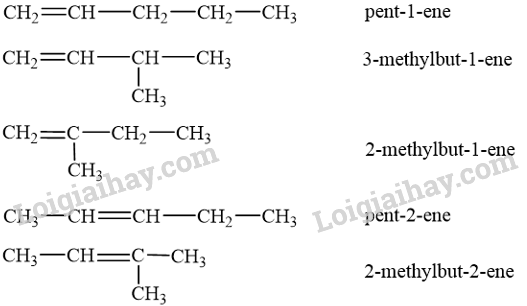
Trong đó pent-2-ene có 2 đồng phân hình học:
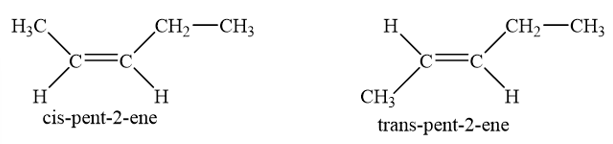
- Công thức cấu tạo của alkyne C5H8:
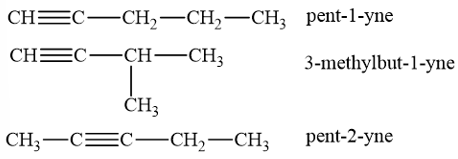
Lời giải:
Đồng phân trans có tổng moment lưỡng cực thường triệt tiêu hoặc gần triệt tiêu, còn đồng phân cis có tổng moment lưỡng cực không triệt tiêu, do đó đồng phân trans có nhiệt độ sôi thấp hơn đồng phân cis.
Ví dụ phân từ cis-but-2-ene và trans-but-2-ene đều chứa nhóm -CH3 là nhóm đẩy electron làm phân tử mỗi chất hình thành các momen lưỡng cực yếu C-C như trong hình bên dưới. Tuy nhiên, cis-but-2-ene có tổng moment lưỡng cực không triệt tiêu, còn trans-but-2-ene có tổng moment lưỡng cực triệt tiêu. Do đó cis-but-2-ene là phần tử phân cực nhẹ trans-but-2-ene là phân tử không phân cực, dẫn đến nhiệt độ sôi của cis-but-2-ene cao hơn so với trans-but-2-ene.
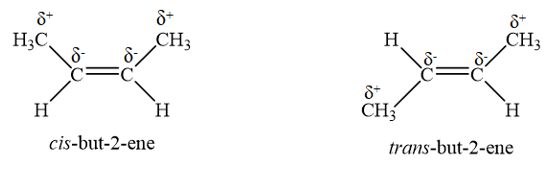
Lời giải:
Tuy liên kết ba C≡C của một alkyne giàu mật độ electron hơn so với liên kết đôi C=C của một alkene tương ứng nhưng khả năng phản ứng cộng (X2, HX, H2O) vào alkyne lại kém hơn vào alkene tương ứng. Điều này có thể giải thích là do nguyên tử carbon trong liên kết C≡C ở trạng thái lai hoá sp, có độ âm điện lớn hơn các nguyên tử carbon trong liên kết C=C ở trạng thái lai hoá sp2, làm cho các electron π trong C≡C bị giữ chặt hơn so với các electron π trong C=C, dẫn đến khả năng phản ứng cộng (X2, HX, H2O) của alkyne kém hơn alkene tương ứng.
Ví dụ ethylene nhanh chóng làm mất màu nước bromine, acetylene làm mất màu nước bromine chậm hơn. Tốc độ mất màu nước bromine của ethylene gấp 5 lần so với acetylene.
Lời giải:
Do nguyên tử bromine có độ âm điện lớn hơn nguyên tử carbon nên liên kết C–Br bị phân cực mạnh về phía bromine, kết quả liên kết đôi của trans-2,3-dibromobut-2-ene có mật độ electron thấp hơn đáng kể so với liên kết đôi của trans-but-2-ene. Chính vì vậy khả năng phản ứng cộng bromine của trans-2,3-dibromobut-2-ene kém hơn so với trans-but-2-ene.
Lời giải:
Phản ứng cộng bromine vào liên kết ba C≡C của một alkyne dễ hơn vào liên kết đôi C=C của một dibromoalkene tương ứng. Điều này được giải thích là do nguyên tử bromine có độ âm điện mạnh, đã làm liên kết C-Br phân cực mạnh về phía bromine, làm mật độ electron trên liên kết đôi của dibromoalkene kém hơn hẳn so với trên liên kết ba của alkyne tương ứng.
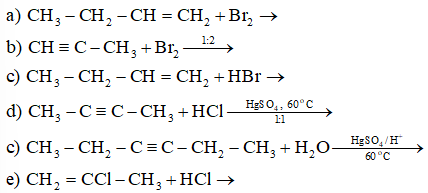
Lời giải:
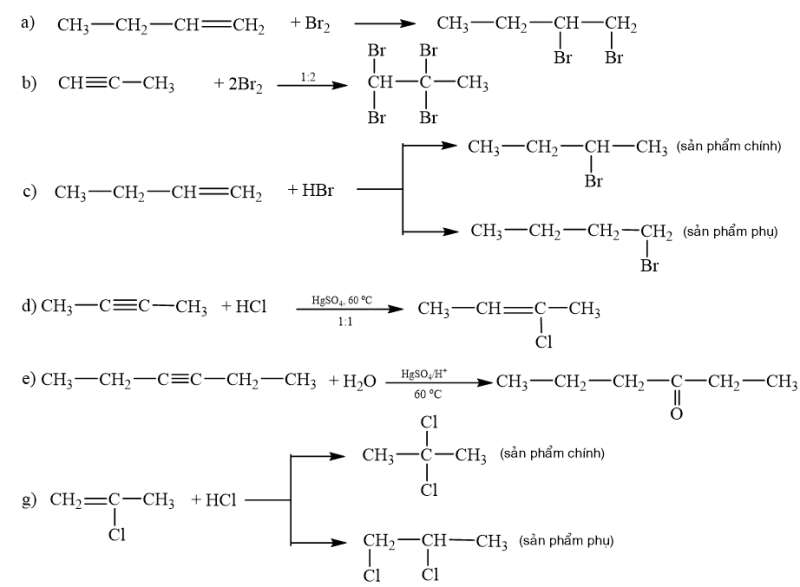
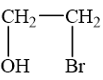
Viết phương trình phản ứng minh hoạ.
Lời giải:
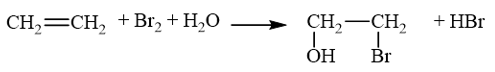
Lời giải:
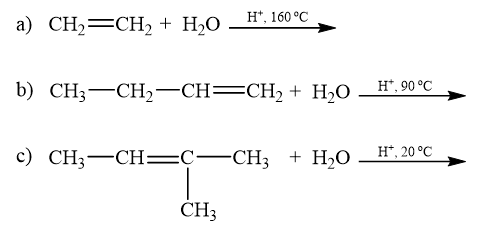
Lời giải:
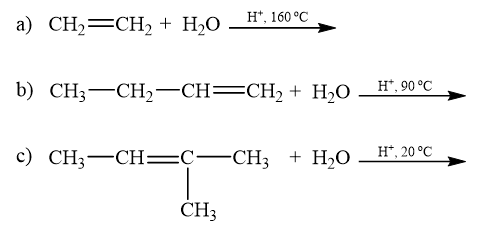
Có thể sử dụng nước bromine để phân biệt hexane và hex-1-ene. Hex-1-ene làm mất màu nước bromine, hexane không làm mất màu nước bromine.
Có thể phân biệt hai chất lỏng này dựa vào kết quả phân tích phổ hồng ngoại vì hex-1-ene có peak 1650 cm-1 của nối đôi C=C, còn hexane thì không.
b) Trình bày phương pháp vật lí phân biệt 2 chất lỏng mất nhãn trên.
Lời giải:
a) Sử dụng AgNO3/NH3 để phân biệt hex-1-yne và hex-2-yne. Hex-1-yne tạo kết tủa vàng nhạt với dung dịch silver nitrate trong ammonia, còn hex-2-yne thì không.
b) Sử dụng phổ hồng ngoại để phân biệt hex-1-yne và hex-2-yne. Vì trong phổ hồng ngoại, peak đặc trưng của các alk-1-yne là peak khoảng 3300 cm-1, các alkyne khác không có peak này. Do đó, phổ hồng ngoại có peak khoảng 3300 cm-1 là hex-1-yne, chất còn lại là hex-2-yne.
Lời giải:
a) Nguyên tử carbon ở trạng thái lai hoá sp có tỉ lệ đóng góp của orbital s là 50%, cao hơn so với nguyên tử carbon ở trạng thái lai hoá sp2 (33,3%) và nguyên tử carbon ở trạng thái lai hoá sp3 (25%) nên orbital lai hoá sp của nguyên tử carbon ở gần hạt nhân hơn, dẫn đến nguyên tử carbon lai hóa sp có độ âm điện cao hơn. Vì thế nguyên tử hydrogen liên kết trực tiếp với các nguyên tử carbon mang liên kết ba có tính linh động.
b) Hydrocarbon có 3 nguyên tử hydrogen linh động có thể là:
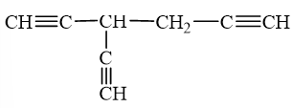
Lời giải:
![]()
nC2H2=15026=7513(mol)⇒nC6H6=13×nC2H2=13×7513=2513(mol)⇒mC6H6(lt)=2513×78=150(g)⇒H=90150×100%=60%
Lời giải:
Đó là do chuối khi chuẩn bị chín sẽ giải phóng một loại hormone thực vật ở thể khí là ethylene, ethylene giúp đẩy nhanh quá trình chín nhiều loại quả khác nhau. Nhờ đó quả bơ cũng được đẩy nhanh chín theo.
Viết các phương trình phản ứng minh hoạ.
Lời giải:
CH2=CH2+Cl2→CH2Cl−CH2ClCH2Cl−CH2Cl→CH2=CH−Cl+HCl
Lời giải:
![]()
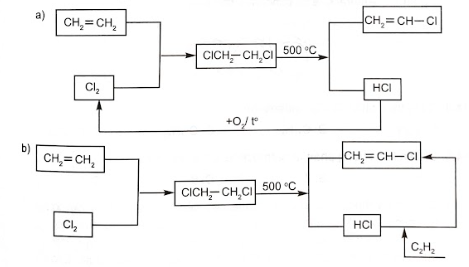
Lời giải:
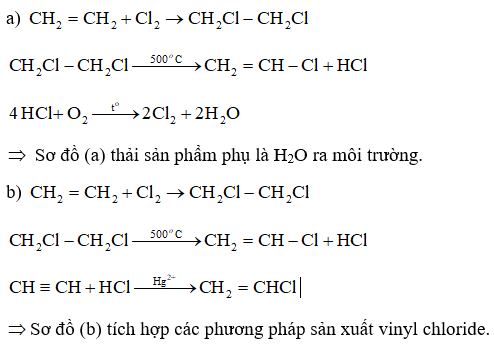
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.