Toptailieu.vn xin giới thiệu Lý thuyết Hydrocarbon không no (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Lý thuyết Hydrocarbon không no (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11
A. Lý thuyết Hydrocarbon không no
1. Khái niệm Alkene và Alkyne
- Alkene là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết đôi C=C trong phân tử, có công thức chung CnH2n (n2).
- Alkyne là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết ba CC trong phân tử, có công thức chung CnH2n-2(n2).
- Phân tử alkene và alkyne chứa liên kết kém bền hơn liên kết .
2. Danh pháp Alkene và Alkyne
Tên theo danh pháp thay thế
Số chỉ vị trí nhánh-tên nhánh + tiền tố ứng với số nguyên tử carbon của mạch chính + số chỉ vị trí liên kết bội + ene(với alkene)/ yne (với alkyne).
3. Đồng phân hình học
- Với các phân tử alkene có từ 4 nguyên tử carbon trở lên, nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hại nguyên tử, nhóm nguyên từ khác nhau sẽ có hai cách phân bố trong không gian.
+ Đồng phân cis-
+ Đồng phân trans-
4. Tính chất vật lý
- Từ C2 đến C4 ở thể khí.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng số nguyên tử carbon trong phân tử.
- Các alkene và alkyne đều nhẹ hơn nước, không tan hoặc rất ít tan trong nước, tan trong dung môi không phân cực.
5. Tính chất hóa học
Do chứa liên kết kém bền trong phân tử, alkene và alkyne có phản ứng đặc trung là phản ứng cộng.
a) Phản ứng cộng
- Cộng hydrogen
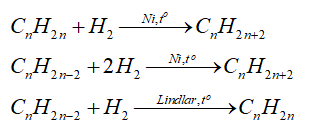
- Cộng halogen
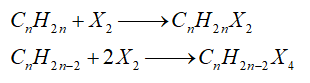
- Cộng hydrogen halide
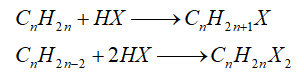
-Cộng nước (hydrate hóa)
+ 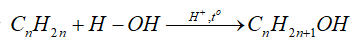
+ Alkyne khó tác dụng với nước hơn, cần xúc tác là muối Hg2+ trong môi trường acid và tạo thành aldehyde hoặc ketone.
- Quy tắc Markovnikov: Nguyên tử hydrogen ưu tiên cộng vào nguyên tử carbon chưa no có nhiều hydrogen hơn, còn nguyên tử X ưu tiên cộng vào nguyên tử carbon chưa no có ít hydrogen hơn.
b) Phản ứng trùng hợp
- Dưới áp suất, xúc tác và nhiệt độ thích hợp, các alkene tham gia phản ứng cộng liên tiếp các phân tử với nhau tạo phân tử polymer.
c) Phản ứng oxi hóa
- Các alkene, alkyne đều bị oxi hóa bởi dung dịch KMnO4 ở điều kiện thường
3C2H4 + 2KMnO4 + 4H2O 3C2H4(OH)2 + 2KOH + 2MnO2
3C2H2 + 2KMnO4 KOOC-COOK + 2KOH + 8MnO2 + 2H2O
-Các alkene, alkyne cháy tỏa nhiều nhiệt
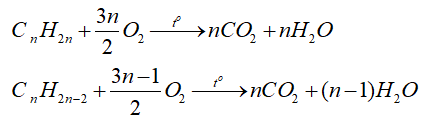
d) Phản ứng riêng alk-1-yne
- Các alk-1-yne như ethyne, propyne,… có phản ứng tạo kết tủa với dung dịch AgNO3 trong ammonia.
6. Ứng dụng và điều chế alkene, alkyne
a) Ứng dụng
- Alkene được sử dụng làm nguyên liệu tổng hợp các chất hữu cơ như PE, PP, ethylene glycol, acetone,..
- Acetylene được sử dụng là nhiên liệu trong hàn cắt kim loại.
- Alkyne là nguyên liệu tổng hợp nên các chất hữu cơ khác nhau như: polyester, polyurethane, cao su neoprene,…
b) Điều chế
- Trong PTN
+ Alkene được điều chế bằng cách dehydrate ancol no, đơn chức, mạch hở tương ứng:
+ Actylene được điều chế bằng cách cho đất đèn tác dụng với nước.
CaC2 + 2H2O C2H2 + Ca(OH)2
- Trong công nghiệp
+ Alkene thu được từ quá trình cracking alkane
+ Acetylene được điều chế trong công nghiệp từ CaC2 hoặc từ CH4
Sơ đồ tư duy Hydrocarbon không no
B. Trắc nghiệm Hydrocarbon không no
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 14: Arene (Hydrocarbon thơm)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.