Toptailieu.vn xin giới thiệu Lý thuyết Alkane (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Lý thuyết Alkane (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11
A. Lý thuyết Alkane
1. Khái niệm về alkane
- Alkane là những hydrocarbon mạch hở chỉ chứa liên kết đơn trong phân tử và có công thức chung là CnH2n+2 (n1).
- Nguồn alkane trong tự nhiên: dầu mỏ, khí dầu mỏ, khí ao hồ.
2. Danh pháp
- Tên theo danh pháp thay thế của alkane không phân nhánh:
Tiền tố ứng với số nguyên tử carbon của alkane + ane
-Tên theo danh pháp thay thế của alkane phân nhánh
Số chỉ vị trí nhánh-Tên nhánh + Tiền tố ứng với số nguyên tử carbon mạch chính + ane
3. Tính chất vật lý
- Ở điều kiện thường, các alkane từ C1 đến C4 ở thể khí.
- Các alkane đều nhẹ hơn hơn nước, không tan truong nước, nhưng tan trong các dung môi không phân cực.
- Khi số nguyên tử carbon tăng, nhiệt độ sôi và nhiệt độ nóng chảy của các alkane tăng.
4. Tính chất hóa học
- Phản ứng thế halogen
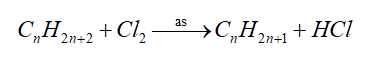
=> Phản ứng đặc trưng của alkane, nguyên tử H liên kết với nguyên tử C bậc cao dễ bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
- Phản ứng cracking: quá trình “bẻ gãy” các phân tử alkane mạch dài thành các phân tử hydrocarbon mạch ngắn hơn.
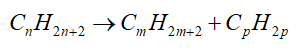
- Phản ứng reforming: quá trình biển đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng.
- Phản ứng oxi hóa
+ Oxi hóa hoàn toàn: các alkane thường dễ cháy và tỏa nhiều nhiệt.
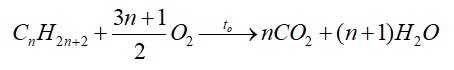
+ Oxi hóa không hoàn toàn: trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C.
5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
- Alkane được sử dụng làm nhiên liệu, dung môi, dầu nhờn,… và nguyên liệu để tổng hợp các chất hữu cơ khác nhau.
- Trong công nghiệp, alkane được khai thác, chế biến từ khí thiên nhiên, khí đồng hành, dầu mỏ.
- Ô nhiễm không khí do khói thải từ các phương tiện giao thông góp phần làm Trái Đất nóng lên và gây ra sự biến đổi khí hậu toàn cầu.
- Tăng cường tham gia vận tải công cộng, giảm sự phụ thuộc nhiên liệu hóa thạch, bảo vệ rừng,… là những cách hạn chế sự ô nhiệm không khí.
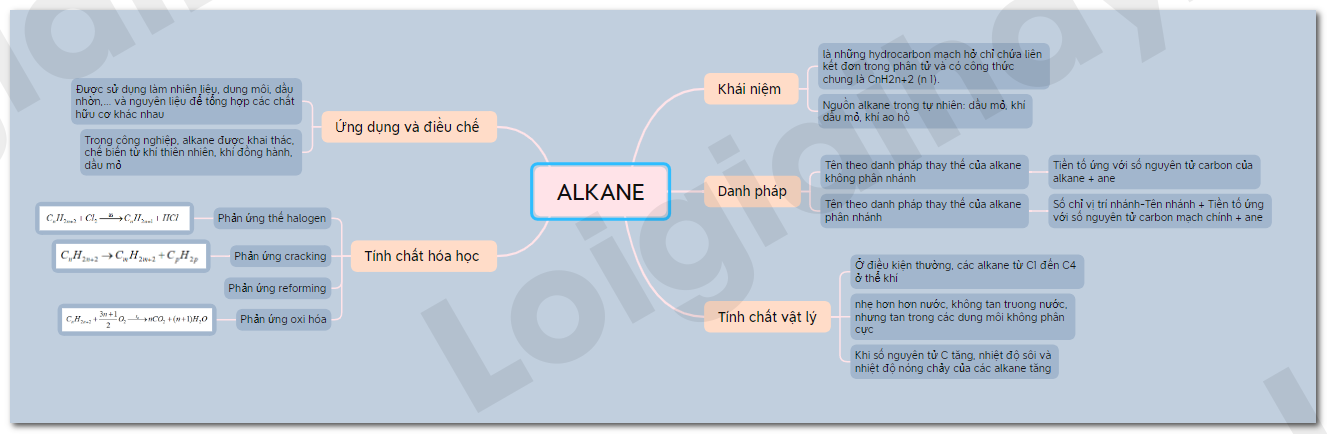
Sơ đồ tư duy Alkane
B. Trắc nghiệm Alkane
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 11: Cấu tạo hóa học hợp chất hữu cơ
Lý thuyết Bài 13: Hydrocarbon không no
Lý thuyết Bài 14: Arene (Hydrocarbon thơm)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.