Toptailieu biên soạn và giới thiệu giải sách bài tập Hóa học 10 Bài 4: Ôn tập chương 1 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm các bài tập từ đó nâng cao kiến thức và biết cách vận dụng phương pháp giải vào các bài tập trong SBT Hóa học 10 Bài 4.
Nội dung bài viết
SBT Hóa học 10 Kết nối tri thức Bài 4: Ôn tập chương 1
Bài 4.1 trang 10 sách bài tập Hóa học 10: Số proton, neutron và electron của C5224r3+ lần lượt là
A. 24, 28, 24
B. 24, 28, 21
C. 24, 30, 21
D. 24, 28, 27
Lời giải:
Đáp án đúng là: B
Số hiệu nguyên tử Z = số proton = 24 = số electron (của Cr nguyên tử).
Số neutron = Số khối – số proton = 52 – 24 = 28.
Cr nhường 3 electron tạo thành Cr3+ ⇒ Số electron (của Cr3+) = 24 – 3 = 21
Bài 4.2 trang 10 sách bài tập Hóa học 10: Tổng số hạt neutron, proton, electron trong ion C3517l− là
A. 52
B. 35
C. 53
D. 51
Lời giải:
Số hiệu nguyên tử Z = số proton = 17 = số electron (của Cl nguyên tử)
Số neutron = Số khối – số proton = 35 – 17 = 18.
Cl nhận 1 electron tạo thành Cl- ⇒ Số electron (của ion Cl-) = 17 + 1 = 18
Bài 4.3 trang 10 sách bài tập Hóa học 10: Nguyên tử của nguyên tố M có số hiệu nguyên tử bằng 20. Cấu hình electron của ion M2+ là
A. 1s22s22p63s23p6
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p63d1
D. 1s22s22p63s23p64s2
Lời giải:
Đáp án đúng là: A
Cấu hình electron của M (Z = 20) là: 1s22s22p63s23p64s2
Nguyên tử M nhường 2 electron lớp ngoài cùng để tạo thành ion M2+
⇒Cấu hình electron của ion M2+ là1s22s22p63s23p6
A. 1s22s2
B. 1s22s22p63s2
C. 1s22s22p4
D. 1s22s22p53s1
Lời giải:
Đáp án đúng là: C
Nguyên tử X nhận 2 electron để tạo thành anion X2-
⇒Cấu hình electron của X là 1s22s22p4
A. Ne
B. F-
C. Cl-
D. Mg2+
Lời giải:
Đáp án đúng là: C
- Nguyên tử O (Z = 8) có cấu hình electron là: 1s22s22p4
Nguyên tử O nhận 2 electron để tạo thành ion O2-
⇒ Cấu hình electron của ion O2- là: 1s22s22p6
- Nguyên tử F (Z = 9) có cấu hình electron là: 1s22s22p5
Nguyên tử F nhận 1 electron để tạo thành ion F-
⇒ Cấu hình electron của ion F- là: 1s22s22p6
- Nguyên tử Cl (Z = 17) có cấu hình electron là: 1s22s22p63s23p5
Nguyên tử Cl nhận 1 electron để tạo thành ion Cl-
⇒ Cấu hình electron của ion Cl- là: 1s22s22p63s23p6
- Nguyên tử Mg (Z = 12) có cấu hình electron là: 1s22s22p63s2
Nguyên tử Mg nhường đi 2 electron lớp ngoài cùng để tạo thành ion Mg2+
⇒ Cấu hình electron của ion Mg2+ là: 1s22s22p6
- Cấu hình electron của Ne (Z = 10) là: 1s22s22p6
Vậy ion O2- không có cùng số electron với ion Cl-
Bài 4.6 trang 11 sách bài tập Hóa học 10: Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ của X2- là
A. 18
B. 16
C. 9
D. 20
Lời giải:
Đáp án đúng là: A
Cấu hình electrond đầy đủ của X2-là 1s22s22p63s23p6
⇒Tổng số electron ở lớp vỏ của X2- là 18.
Bài 4.7 trang 11 sách bài tập Hóa học 10: Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M là
A. 3
B. 2
C. 1
D. 0
Lời giải:
Đáp án đúng là: B
Cấu hình electron lớp ngoài cùng biểu diễn trên AO là:
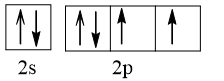
⇒ Có 2 electron độc thân.
Bài 4.8 trang 11 sách bài tập Hóa học 10: Nguyên tố Q có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố Q điền vào lớp, phân lớp nào sau đây?
A. K, s
B. L, p
C. M, p
D. N, d
Lời giải:
Đáp án đúng là: C
Số hiệu nguyên tử = số electron = 14
⇒ Cấu hình electron là: 1s22s22p63s23p2
⇒ Electron cuối cùng điền vào lớp M (n = 3), phân lớp p
Bài 4.9 trang 11 sách bài tập Hóa học 10: Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng là: 1s2s2p3s3p4s3d ...
Cấu hình electron của nguyên tử Y là
A. 1s22s22p63s23p64s23d6
B. 1s22s22p63s23p63d64s2
C. 1s22s22p63s23p63d8
D. 1s22s22p63s23p63d6
Lời giải:
Đáp án đúng là: B
Các electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d6
Sắp xếp lại: 1s22s22p63s23p63d64s2
Bài 4.10 trang 11 sách bài tập Hóa học 10: Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2. Tổng số electron của nguyên tử nguyên tố X là
A. 18
B. 20
C. 22
D. 24
Lời giải:
Đáp án đúng là: C
Electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d2
Sắp xếp lại: 1s22s22p63s23p63d24s2
⇒Tổng số electron của nguyên tử nguyên tố X là 22
Bài 4.11 trang 11 sách bài tập Hóa học 10: Ion nào sau đây không có cấu hình electron của khí hiếm?
A. Na+
B. Al3+
C. Cl-
D. Fe2+
Lời giải:
Đáp án đúng là: D
|
Cấu hình electron nguyên tử |
Cấu hình electron ion tương ứng |
|
Na (Z = 11): 1s22s22p63s1 |
Na+: 1s22s22p6 |
|
Al (Z = 13): 1s22s22p63s23p1 |
Al3+: 1s22s22p6 |
|
Cl (Z = 17): 1s22s22p63s23p5 |
Cl-: 1s22s22p63s23p6 |
|
Fe (Z = 26): 1s22s22p63s23p63d64s2 |
Fe2+: 1s22s22p63s23p63d6 |
Vậy ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
Bài 4.12 trang 11 sách bài tập Hóa học 10: Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1. Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3. Số proton của X và Y lần lượt là
A. 13 và 15
B. 12 và 14
C. 13 và 14
D. 12 và 15
Lời giải:
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s23p1
⇒ Số electron của X = số proton = 13
Cấu hình electron của Y là: 1s22s22p63s23p3
⇒ Số electron của Y = số proton = 15
Bài 4.13 trang 11 sách bài tập Hóa học 10: Cho các nguyên tố có điện tích hạt nhân như sau: Z = 7, Z = 14 và Zn = 21. Biểu diễn cấu hình electron của nguyên tử theo ô orbital. Tại sao lại phân bố như vậy?
Lời giải:
Z = 7:
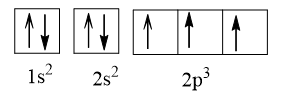
Z = 14:
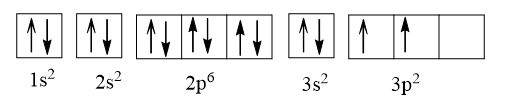
Giải thích: Cấu hình electron được viết tuân theo nguyên lí vững bền, nguyên lí Pauli và phần 2p3, 3p2 tuân theo quy tắc Hund.
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.

Giải thích: Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của các electron trong mỗi phân lớp tăng dần từ trái sang phải
Bài 4.14 trang 11 sách bài tập Hóa học 10: Cho các nguyên tố có điện tích hạt nhân như sau: Z = 9, Z = 16, Z = 18, Z = 20 và Z = 29. Các nguyên tố trên là kim loại, hay phi kim hay khí hiếm?
Lời giải:
Cấu hình electron nguyên tử của các nguyên tố
Z = 9 (1s22s22p5) ⇒ lớp ngoài cùng có 7e ⇒ phi kim.
Z = 16 ([Ne]3s22p4) ⇒ lớp ngoài cùng có 6e ⇒ phi kim.
Z = 18 (1s22s22p63s23p6) ⇒ lớp ngoài cùng có 8e ⇒ khí hiếm.
Z = 20 ([Ar]4s2) ⇒ lớp ngoài cùng có 2e ⇒ kim loại.
Z = 29 ([Ar]3d104s1) ⇒ lớp ngoài cùng có 1e ⇒ kim loại.
A. 1s22s22p3
B. 1s22s22p2
C. 1s22s22p1
D. 1s22s2
Lời giải:
Đáp án đúng là: D
Với các nguyên tử bền ta có: 1 ≤ ≤ 1,52 (1)
Theo bài ra có:
2Z + N = 13 ⇒ N = 13 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 13 – 2Z ≤ 1,52Z
⇔ 3,69 ≤ Z ≤ 4,33
Chọn Z = 4 ⇒ N = 5
⇒Cấu hình electron của nguyên tử X là1s22s2
Bài 4.16 trang 12 sách bài tập Hóa học 10: Cho nguyên tử R có tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14. Cấu hình electron nguyên tử của R là
A. [Ne]3s22p3
B. [Ne]3s22p5
C. [Ar]3d14s2
D. [Ar]4s2
Lời giải:
Đáp án đúng là: A
Tổng số hạt cơ bản là 46 nên ta có: p + e + n = 46 hay 2p + n = 46 (1)
Hạt mang điện là p và e; hạt không mang điện là n nên ta có:
p + e – n = 14 hay 2p – n = 14 (2)
Từ (1) và (2) ⇒ p = e = 15, n = 16
Cấu hình electron nguyên tử của R là: [Ne]3s22p3
Bài 4.17 trang 12 sách bài tập Hóa học 10: Nguyên tố X được sử dụng rộng rãi trong đời sống: đúc tiền, làm đồ trang sức, làm răng giả, ... Muối iodine
Lời giải:
Tổng các hạt cơ bản của X: p + e + n = 155 hay 2p + n = 155 (1)
Hạt mang điện là p + e và hạt không mang điện là n nên ta có:
2p – n = 33 (2)
Giải hệ (1) và (2) ta được: p = 47; n = 61
⇒ Nguyên tố X có Z = số p = 47.
Số khối bằng p + n = 47 + 61 = 108
⇒ X là silver ( A10847g)
Bài 4.18 trang 12 sách bài tập Hóa học 10: Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82. Số hạt mang điện nhiều hơn số hạt không mang điện là 22.
a) Viết kí hiệu nguyên tử của nguyên tố X.
b) Xác định số lượng các hạt cơ bản trong ion X2+ và viết cấu hình electron của ion đó.
Lời giải:
a) Tổng các hạt cơ bản của X: p + e + n = 82 hay 2p + n = 82 (1)
Hạt mang điện là p + e và hạt không mang điện là n nên ta có:
2p – n = 22 (2)
Giải hệ (1) và (2) ta được: p = 26; n = 30
⇒ Nguyên tố X có Z = số p = 26.
Số khối bằng p + n = 26 + 30 = 56
⇒ X là iron (F5626e )
b) Nguyên tử Fe nhường 2 electron để tạo thành ion Fe2+
Cấu hình electron của Fe: 1s22s22p63s23p63d64s2.
Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Bài 4.19 trang 12 sách bài tập Hóa học 10: rong tự nhiên, hợp chất X tồn tại ở dạng quặng có công thức ABY2. X được khai thác và sử dụng nhiều trong luyện kim hoặc sản xuất acid. Trong phân tử X, nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài cùng là 4s, các ion A2+, B2+ có số electron ngoài cùng lần lượt là 17 và 14. Tổng số proton trong X là 87.
a) Viết cấu hình electron nguyên tử của A và B.
b) Xác định X.
Lời giải:
a) Cấu hình electron của A và B có dạng:
[Ne]3s23p63dx4sy (0 ≤ x ≤ 10; 1 ≤ y ≤ 2)
- Nếu y = 1 thì cấu hình của A2+ là: [Ne]3s23p63dx-1
Khi đó có: 2 + 6 + x – 1 = 17 ⇒ x = 10
Cấu hình electron của A là: [Ar]3d104s1
⇒ A là 29Cu
- Nếu y = 2 thì cấu hình của A2+ là: [Ne]3s23p63dx
Khi đó có: 2 + 6 + x = 17 ⇒ x = 9
Cấu hình electron của A là: [Ar]3d94s2 (không bền vững)
Xét tương tự với B:
- Nếu y = 1 thì cấu hình electron của B là [Ar]3d74s1 (không hợp lí)
- Nếu y = 2 thì cấu hình electron của B là [Ar]3d64s1 . B là 26Fe
b) Tổng số proton trong X là 87.
⇒ pA + pB + 2pY = 87
⇔ 29 + 26 + 2.pY = 87
⇔ pY = 16
⇒ Y là 16S
Vậy quặng X có công thức là: CuFeS2
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.