Toptailieu biên soạn và giới thiệu giải sách bài tập Hóa học 10 Bài 2: Nguyên tố hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm các bài tập từ đó nâng cao kiến thức và biết cách vận dụng phương pháp giải vào các bài tập trong SBT Hóa học 10 Bài 2.
Nội dung bài viết
SBT Hóa học 10 Kết nối tri thức Bài 2: Nguyên tố hóa học
Bài 2.1 trang 6 sách bài tập Hóa học 10: Phát biểu nào sau đây không đúng?
A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử
B. Số khối của hạt nhân bằng tổng số proton và số neutron.
C. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron.
D. Nguyên tố hóa học là những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Lời giải:
Đáp án đúng là: C
Phát biểu C là sai. Sửa lại đúng là: Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số electron.
Bài 2.2 trang 6 sách bài tập Hóa học 10: Số hiệu nguyên tử cho biết thông tin nào sau đây?
A. Số proton
B. Số neutron
C. Số khối
D. Nguyên tử khối
Lời giải:
Đáp án đúng là: A
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = số electron.
A.X146,Y147,Z148
B.X199,Y1910,Z2010
C.X2814,Y2914,Z3014
D.X4018,Y4019,Z4020
Lời giải:
Đáp án đúng là: C
Dãy X2814,Y2914,Z3014 gồm các đồng vị của cùng một nguyên tố hóa học vì cùng có Z = 14.
Bài 2.4 trang 6 sách bài tập Hóa học 10: Kí hiệu nào sau đây viết đúng?
A.N157
B.O16
C.S16
D.Mg2412
Lời giải:
Đáp án đúng là: A
Cách viết kí hiệu nguyên tử:
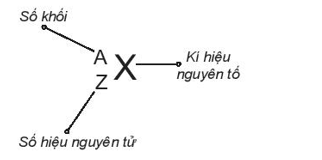
Bài 2.5 trang 6 sách bài tập Hóa học 10: Thông tin nào sau đây không đúng về P20682b?
A. Số đơn vị điện tích hạt nhân là 82.
B. Số proton và neutron là 82
C. Số neutron là 124
D. Số khối là 206
Lời giải:
Đáp án đúng là: B
Kí hiệu nguyên tử P20682bcho biết:
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = số electron = 82
Số khối = 206
Số neutron = số khối – số hiệu nguyên tử = 206 – 82 = 124
Bài 2.6 trang 6 sách bài tập Hóa học 10: Cho kí hiệu các nguyên tử sau
X146,Y147,Z168,T199,Q178,M169,E1910,G167,L188
Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hóa học?
A.X146,Y147,Z168
B. Z168,M169,G167
C.Q178,M169,E1910
D.Z168,Q178,L188
Lời giải:
Đáp án đúng là: D
Các nguyên tử Z168,Q178,L188 thuộc cùng một nguyên tố hóa học vì cùng có Z = 8.
Bài 2.7 trang 6 sách bài tập Hóa học 10: Nitrogen có hai đồng vị bền là N147 và N157. Oxygen có ba đồng vị bền là O168,O178 và O188 . Số hợp chất NO2 tạo bởi các đồng vị trên là
A. 3
B. 6
C. 9
D. 12
Lời giải:
Đáp án đúng là: D
Đồng vị N147 kết hợp với (O168 , O168 ); (O178 , O178 ); (O188, O188); ( O168;O178 ); ( O168, O188); ( O178,O188 ) được 6 hợp chất NO2.
Tương tự, đồng vị N157 kết hợp vớ 6 cặp đồng vị O như trên được 6 hợp chất NO2 nữa.
Bài 2.8 trang 7 sách bài tập Hóa học 10: Trong tự nhiên, bromine có hai đồng vị bền là chiếm 50,69% số nguyên tử và B8135r chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
A. 80,00
B. 80,112
C. 80,986
D. 79,986
Lời giải:
Đáp án đúng là: D
Nguyên tử khối trung bình của bromine là:
ˉA=79.50,69+81.49,31100= 79,986
Bài 2.9 trang 7 sách bài tập Hóa học 10: Oxygen có ba đồng vị với tỉ lệ % số nguyên tử tương ứng là O16 (99,757%),O17 (0,038%), O18 (0,205%). Nguyên tử khối trung bình của oxygen là
A. 16,0
B. 16,2
C. 17,0
D. 18,0
Lời giải:
Đáp án đúng là: A
Nguyên tử khối trung bình của oxygen là:
ˉA=16.99,757+17.0,038+18.0,205100= 16,0
Bài 2.10 trang 7 sách bài tập Hóa học 10: Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là 79,91. Một trong hai đồng vị là R79 (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
A. 80
B. 81
C. 82
D. 80,5
Lời giải:
Đáp án đúng là: B
Đặt nguyên tử khối của đồng vị thứ hai là A2
Phần trăm đồng vị A2 là 100% - 54,5% = 45,5%
Ta có: ˉA=79,91=79.54,5+A2.45,5100
⇒ A2 = 81
Vậy nguyên tử khối của đồng vị thứ hai là 81.
Bài 2.11 trang 7 sách bài tập Hóa học 10: Boron là nguyên tố có nhiều tác dụng đối với cơ thể người như: làm lành vết thương, điều hòa nội tiết sinh dục, chống viêm khớp, ... Do ngọn lửa cháy có màu lục đặc biệt nên boron vô định hình được dùng làm pháo hoa. Boron có hai đồng vị là và , nguyên tử khối trung bình là 10,81. Tính phần trăm số nguyên tử mỗi đồng vị của boron.
Lời giải:
Gọi %B10 là x, %B11 = 100 – x
Ta có: ˉA=10,81=10x+11(100–x)100
⇒ x = 19 và 100 – x = 81.
Vậy phần trăm số nguyên tử B10 là 19% và B11 là 81%
Bài 2.12 trang 7 sách bài tập Hóa học 10: Đồng vị phóng xạ cobalt (Co – 60) phát ra tia γ có khả năng đâm xuyên mạnh, dùng điều trị các khối u ở sâu trong cơ thể. Cobalt có ba đồng vị: C5927o (chiếm 98%), C5827o và C6027o ; nguyên tử khối trung bình là 58,982. Xác định hàm lượng % của đồng vị phóng xạ Co – 60.
Lời giải:
Gọi hàm lượng C5827o và C6027o lần lượt là x% và y%.
Ta có: 98 + x + y = 100 (1)
ˉA=58,982=59.98+58.x+60.y100(2)
Giải hệ hai phương trình (1) và (2) ta được: x = 1,9 và y = 0,1
Vậy hàm lượng % của đồng vị phóng xạ Co – 60 là 0,1%
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.