Toptailieu biên soạn và sưu tầm lời giải bài tập Hóa học lớp 10 Bài 2: Nguyên tố hoá học sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 2 từ đó học tốt môn Hóa 10.
Nội dung bài viết
Hoá học 10 Kết nối tri thức Bài 2: Nguyên tố hoá học
Câu hỏi mở đầu trang 17 Hoá học 10: Các nguyên tử có cùng số đơn vị điện tích hạt nhân thì có đặc điểm gì chung? Giữa số đơn vị điện tích hạt nhân, số proton và số electron có mối liên hệ như thế nào?
Phương pháp giải:
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
- Một nguyên tử trung hòa về điện có số proton = số electron
- Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân
Lời giải:
- Các nguyên tử có cùng số đơn vị điện tích hạt nhân sẽ thuộc cùng loại nguyên tố hóa học
- Một nguyên tử trung hòa về điện có số proton = số electron. Mà số proton trong hạt nhân = số đơn vị điện tích hạt nhân
=> Số đơn vị điện tích hạt nhân = số proton = số electron
I. Nguyên tố hoá học
Câu hỏi 1 trang 17 Hoá học 10: Cho các nguyên tử sau: L (Z = 8, A = 16), D (Z = 9, A = 19), E (Z = 8, A = 18), G (Z = 7, A = 15). Trong các nguyên tử trên, các nguyên tử nào thuộc cùng một nguyên tố hóa học?
Phương pháp giải:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
Lời giải:
- Ta có:
+ L có Z = 8
+ D có Z = 9
+ E có Z = 8
+ G có Z = 7
=> Nguyên tử L và E thuộc cùng 1 nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8)
II. Kí hiệu nguyên tử
Câu hỏi 2 trang 18 Hoá học 10: Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ
Phương pháp giải:
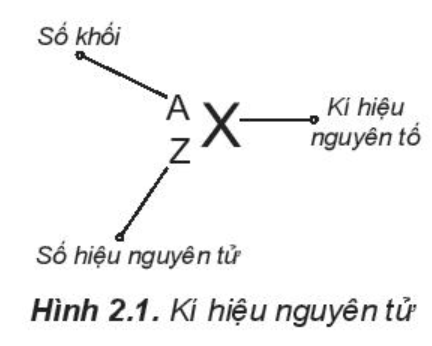
Lời giải:
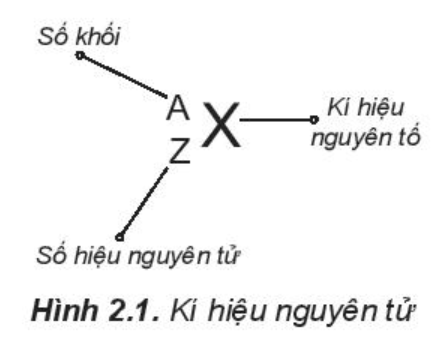
- Kí hiệu một nguyên tử cho biết:
+ Kí hiệu của nguyên tố đó
+ Số hiệu nguyên tử => Số proton và số electron
+ Số khối => Số neutron = Số khối – số proton
- Ví dụ: 168O cho biết:
+ Nguyên tố oxygen, kí hiệu: O
+ Oxygen có số hiệu nguyên tử = số prtoton = số electron = 8
+ Số khối của oxygen = 16 => Số neutron = 16 – 8 = 8
Câu hỏi 3 trang 18 Hoá học 10: Hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7)
b) Phosphorus (số proton = 15 và số neutron = 16)
c) Copper (số proton = 29 và số neutron = 34)
Phương pháp giải:
Trong 1 nguyên tử:
+ Số proton = số hiệu nguyên tử = Z
+ Số khối: A = số proton + số neutron
Lời giải:
a) Nitrogen ( số proton = 7 và số neutron = 7)
+ Nitrogen có kí hiệu nguyên tố: N
+ Số proton = Z = số hiệu nguyên tử = 7
+ Số khối: A = số proton + số neutron = 7 + 7 = 14
=> Kí hiệu nguyên tử: 147N
b) Phosphorus ( số proton = 15 và số neutron = 16)
+ Phosphorus có kí hiệu nguyên tố: P
+ Số proton = Z = số hiệu nguyên tử = 15
+ Số khối: A = số proton + số neutron = 15 + 16 = 31
=> Kí hiệu nguyên tử: 3115P
c) Copper ( số proton = 29 và số neutron = 34)
+ Copper có kí hiệu nguyên tố: Cu
+ Số proton = Z = số hiệu nguyên tử = 29
+ Số khối: A = số proton + số neutron = 29 + 34 = 63
=> Kí hiệu nguyên tử: 6329Cu
III. Đồng vị
a) 2814Si, 2914Si, 3014Si
b) 5426Fe, 5626Fe, 5726Fe, 5826Fe
Phương pháp giải:
- Kí hiệu một nguyên tử cho biết:
+ Kí hiệu của nguyên tố đó
+ Số hiệu nguyên tử = số proton = số electron
+ Số neutron = số khối – số proton
Lời giải:
a)
|
2814Si |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 28 – 14 = 14 |
|
2914Si |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 29 – 14 = 15 |
|
3014Si |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 30 – 14 = 16 |
b)
|
5426Fe |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 54 – 26 = 28 |
|
5626Fe |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 56 – 26 = 30 |
|
5726Fe |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 57 – 26 = 31 |
|
5826Fe |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 58 – 26 = 32 |
IV. Nguyên tử khối
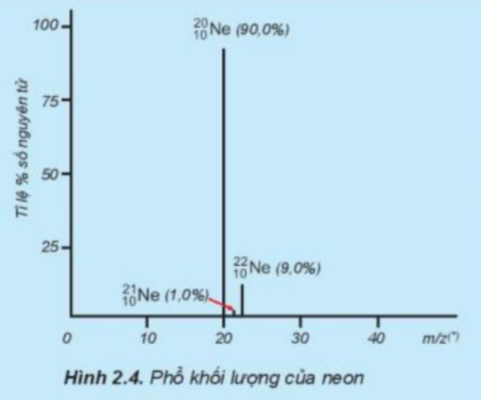
Câu hỏi 5 trang 20 Hoá học 10: Tỉ lệ phần trăm số nguyên tử các đồng vị của neon (Ne) được xác định theo phổ khối lượng (Hình 2.4). Tính nguyên tử khối trung bình của Ne.
Phương pháp giải:
- Nguyên tử khối trung bình của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
- Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
Ta có: 20Nechiếm 90,0%; 21Nechiếm 1,0%; 22Nechiếm 9,0%
=> MNe=90.20+1.21+9.22100=20,19
Vậy nguyên tử khối trung bình của Ar là 20,19
Phương pháp giải:
Vì trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr.
Lời giải:
Trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr.
=> Tính giá trị nguyên tử khối của chromium sẽ không phải là số nguyên mà là 51,996
M=aA+bB+cC+dD+...100
Câu hỏi 7 trang 20 Hoá học 10: Copper (đồng) được sử dụng làm dây dẫn điện, huy chương, trống đồng… Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị và . Tính phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên.
Phương pháp giải:
- Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
- Gọi tỉ lệ đồng vị 63Cu trong tự nhiên là x%
=> Tỉ lệ đồng vị 65Cu trong tự nhiên là (100-x)%
- Nguyên tử khối trung bình của Cu là 63,546
=> 63,546=63.x+65.(100−x)100
=> x = 72,7
Vậy đồng vị 63Cu chiếm 72,7% trong tự nhiên
Lý thuyết Bài 2: Nguyên tố hóa học
I. Nguyên tố hóa học
- Là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
- Trong nguyên tử, số đơn vị điện tích hạt nhân = số electron ở vỏ nguyên tử
Ví dụ: Tất cả nguyên tử có số đơn vị điện tích hạt nhân = 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau

- Hiện nay, con người đã biết 118 nguyên tố hóa học, trong đó có 94 nguyên tố hóa học tồn tại trong tự nhiên và 24 nguyên tố được tạo ra trong phòng thí nghiệm
II. Kí hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z)) của nguyên tố đó và số khối (A) là những đặc trưng cơ bản của 1 nguyên tử
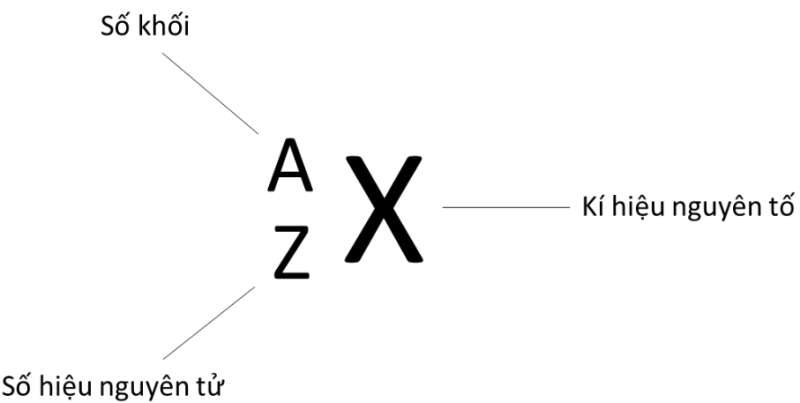
Ví dụ: Kí hiệu 2311Na cho biết:
- Nguyên tử sodium có kí hiệu là Na
- Số hiệu nguyên tử sodium = 11 nên hạt nhân sodium có 11 proton, vỏ nguyên tử có 11 electron
- Số khối của nguyên tử Na là 23 nên trong hạt nhân có số neutron là 23 – 11 = 12
III. Đồng vị
- Một số nguyên tử có cùng số proton nhưng có số neutron khác nhau, những nguyên tử như vậy được gọi là đồng vị
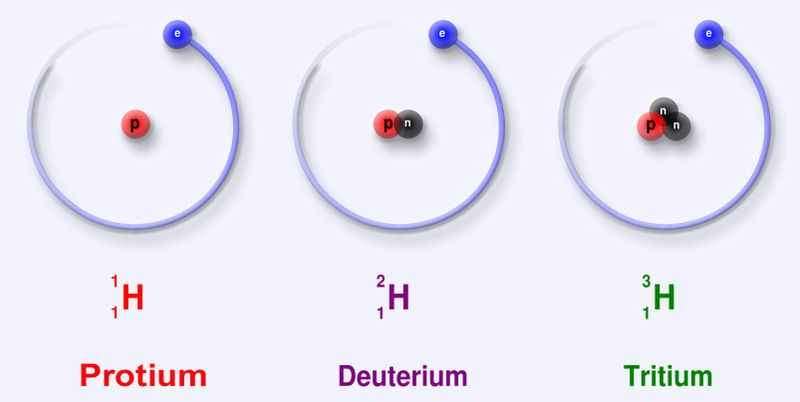
- Các đồng vị khác nhau về số neutron nên cũng khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời cũng khác nhau về một số tính chất vật lí
Ví dụ: ở dạng đơn chất, đồng vị 3717Cl có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị 3517Cl
- Ngoài các đồng vị bền, các nguyên tố hóa học còn có đồng vị không bền được gọi là đồng vị phóng xạ. Nhiều đồng vị phóng xạ được sử dụng trong y học, nông nghiệp, công nghiệp, nghiên cứu khoa học,…
IV. Nguyên tử khối
1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử
- Do khối lượng của proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu) nên có thể coi nguyên tử khối xấp xỉ số khối hạt nhân
Ví dụ: Nguyên tử của nguyên tố potassium (K) có Z = 19; số neutron = 20 nên nguyên tử khối của K là 19 + 20 = 39
2. Nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu là ¯A) của hỗn hợp các đồng vị của nguyên tố đó
Ví dụ: Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên, nguyên tố chlorine có 2 đồng bị bền là 3517Cl (chiếm 75,77%) và 3717Cl (chiếm 24,23% số nguyên tử)
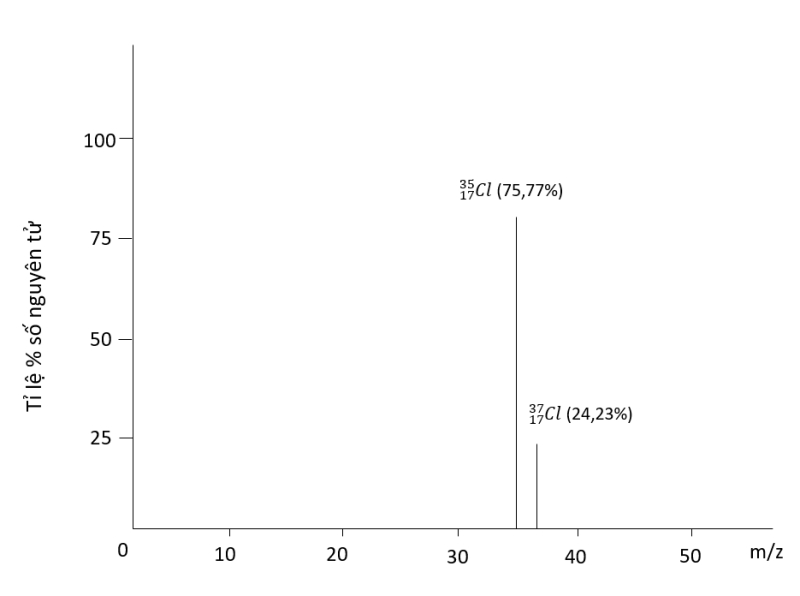
Phố khối lượng của chlorine
Nguyên tử khối trung bình của chlorine:
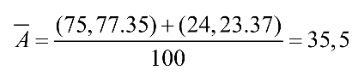
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 1: Thành phần của nguyên tử
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hoá học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.