Với giải Câu hỏi trang 20 SGK Hoá học10 Kết nối tri thức trong Bài 2: Nguyên tố hoá học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Kết nối tri thức trang 20 Bài 2: Nguyên tố hoá học
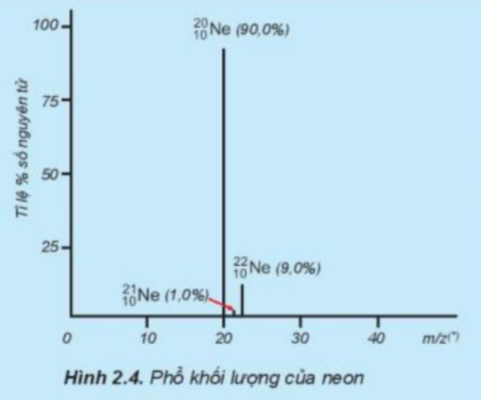
Câu hỏi 5 trang 20 Hoá học 10: Tỉ lệ phần trăm số nguyên tử các đồng vị của neon (Ne) được xác định theo phổ khối lượng (Hình 2.4). Tính nguyên tử khối trung bình của Ne.
Phương pháp giải:
- Nguyên tử khối trung bình của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
- Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
Ta có: 20Nechiếm 90,0%; 21Nechiếm 1,0%; 22Nechiếm 9,0%
=> MNe=90.20+1.21+9.22100=20,19
Vậy nguyên tử khối trung bình của Ar là 20,19
Phương pháp giải:
Vì trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr.
Lời giải:
Trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr.
=> Tính giá trị nguyên tử khối của chromium sẽ không phải là số nguyên mà là 51,996
M=aA+bB+cC+dD+...100
Câu hỏi 7 trang 20 Hoá học 10: Copper (đồng) được sử dụng làm dây dẫn điện, huy chương, trống đồng… Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị và . Tính phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên.
Phương pháp giải:
- Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
- Gọi tỉ lệ đồng vị 63Cu trong tự nhiên là x%
=> Tỉ lệ đồng vị 65Cu trong tự nhiên là (100-x)%
- Nguyên tử khối trung bình của Cu là 63,546
=> 63,546=63.x+65.(100−x)100
=> x = 72,7
Vậy đồng vị 63Cu chiếm 72,7% trong tự nhiên
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Câu hỏi 2 trang 18 Hoá học 10: Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ...
Câu hỏi 3 trang 18 Hoá học 10: Hãy biểu diễn kí hiệu của một số nguyên tử sau...
Câu hỏi 7 trang 20 Hoá học 10: Copper (đồng) được sử dụng làm dây dẫn điện, huy chương, trống đồng… Nguyên tử khối trung bình của copper bằng 63,546...
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 1: Thành phần của nguyên tử
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hoá học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.