Toptailieu biên soạn và sưu tầm lời giải bài tập Hóa học lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử | Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 3 từ đó học tốt môn Hóa 10.
Nội dung bài viết
Hoá học 10 Kết nối tri thức Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Phương pháp giải:
- Electron chuyển động rất nhanh, không theo quỹ đạo xác định
- Electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao
Lời giải:
- Trong nguyên tử, electron luôn chuyển động rất nhanh quanh hạt nhân, không theo quỹ đạo xác định và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định
- Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao (nguyên lí vững bền)
- Trong cùng 1 phân lớp, các electron sẽ phân bổ trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (quy tắc Hund).
I. Chuyển động của electron trong nguyên tử
Phương pháp giải:
Electron chuyển động rất nhanh, không theo quỹ đạo xác định
Lời giải:
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (khoảng 90%)
Câu hỏi 2 trang 22 Hoá học 10: Orbital s có dạng
A. hình tròn
B. hình số tám nổi
C. hình cầu
D. hình bầu dục
Phương pháp giải:
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
Lời giải:
Các orbital s có dạng hình cầu
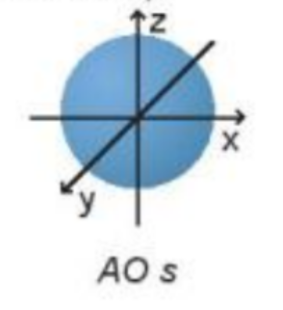
Đáp án C
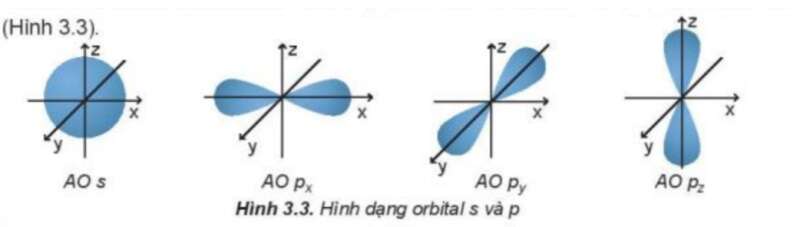
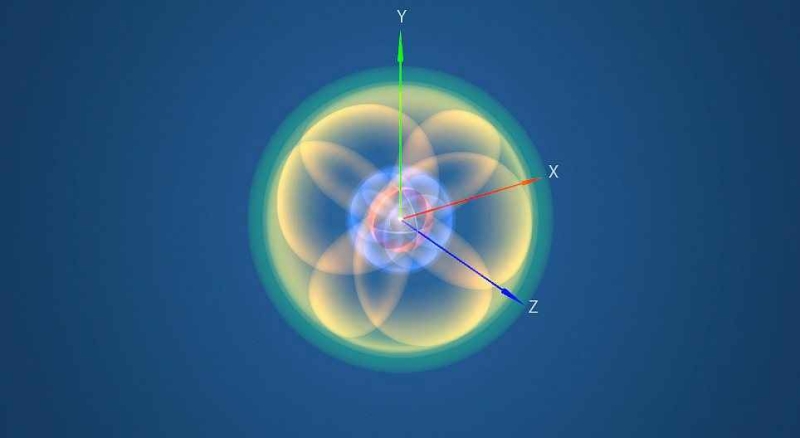
Câu hỏi 3 trang 22 Hoá học 10: Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian
Phương pháp giải:
Các orbital p trong không gian vuông góc với nhau, nằm trên trục x, y, z của hệ tọa độ Đề các
Lời giải:
- Orbital p gồm 3 orbital px, py, pz có dạng hình số 8 nổi.
- Mỗi orbital só sự định hướng khác nhau trong không gian, chẳng hạn như:
+ Orbital px định hướng theo trục x
+ Orbital py định hướng theo trục y
+ Orbital pz định hướng theo trục z
II. Lớp và phân lớp electron
Câu hỏi 4 trang 23 Hoá học 10:Hãy cho biết tổng số electron tối đa chứa trong
a) Phân lớp p
b) Phân lớp d
Phương pháp giải:
a) Phân lớp p có 3 orbital
b) Phân lớp d có 5 orbital
=> Mỗi orbital chứa tối đa 2 electron
Lời giải:
a) Phân lớp p có 3 AO px, py, pz. Trong đó mỗi AO chứa tối đa 2 electron
=> Số electron tối đa chứ trong phân lớp p = 3 x 2 = 6 electron
b) Phân lớp d có 5 AO. Trong đó mỗi AO chứa tối đa 2 electron
=> Số electron tối đa chứ trong phân lớp d = 5 x 2 = 10 electron
A. 2 và 8
B. 8 và 10
C. 8 và 18
D. 18 và 32
Phương pháp giải:
- Lớp thứ 2 (lớp L) có 2 phân lớp, được kí hiệu là 2s, 2p
- Lớp thứ 3 (lớp M) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d
- Phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO
Lời giải:
- Lớp thứ 2 (lớp L) có 2 phân lớp, được kí hiệu là 2s, 2p
- Mà phân lớp s có 1 AO, phân lớp p có 3 AO. Mỗi AO chứa tối đa 2 electron
=> Tổng số electron tối đa có trong lớp L = 1x2 + 3x2 = 8 electron
- Lớp thứ 3 (lớp M) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d
- Mà phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron
=> Tổng số electron tối đa có trong lớp L = 1x2 + 3x2 + 5x2 = 18 electron
III. Cấu hình electron của nguyên tử
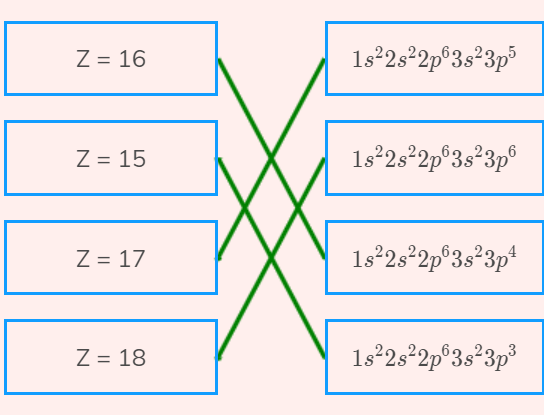
Câu hỏi 6 trang 24 Hoá học 10: Cấu hình electron của nguyên tử có Z = 16 là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p5
C. 1s22s22p63s23p4
D. 1s22s22p63s23p5
Phương pháp giải:
Bước 1: Xác định số electron trong nguyên tử
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d…
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
Lời giải:
- Nguyên tử có Z = 16 => Có 16 electron
- Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
- Điền các electron: 1s22s22p63s23p4
Đáp án C
Phương pháp giải:
Bước 1: Viết cấu hình electron của nguyên tử
Bước 2: Vẽ các AO ứng với mỗi phân lớp trong đó ( phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO, phân lớp f có 7 AO)
+ Mỗi AO chứa tối đa 2 electron được biểu diễn bằng 2 mũi tên ngược chiều nhau và phân bố trên các orbital sao cho số electron độc thân là tối đa (quy tắc Hund)
Lời giải:
- Nguyên tử có Z = 8 => Có 8 electron
- Điền các electron: 1s22s22p4
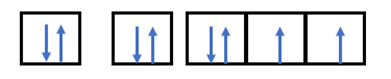
- Nguyên tử có Z = 11 => Có 11 electron
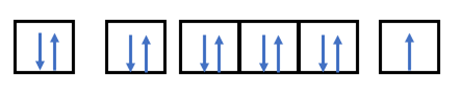
- Điền các electron: 1s22s22p63s1
Câu hỏi 8 trang 25 Hoá học 10: Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn,… Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund
Phương pháp giải:
- Nguyên lí vững bền: các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao
- Nguyên lí Pauli: trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau
- Quy tắc Hund: trong cùng 1 phân lớp, các electron độc thân là tối đa và các electron này có chiều tự quay giống nhau
Lời giải:
- Nguyên tử có Z = 14 => Có 14 electron
- Điền các electron: 1s22s22p63s23p2
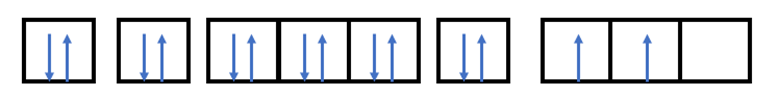
- Nguyên lí vững bền: các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm orbital mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d…
- Nguyên lí Pauli: trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau, nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên
- Quy tắc Hund: trong cùng 1 phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa, các electron này có chiều tự quay giống nhau
Câu hỏi 9 trang 25 Hoá học 10: Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim
Phương pháp giải:
Bước 1: Xác định số electron trong nguyên tử
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d…
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim
Lời giải:
- Nguyên tử chlorine có Z = 17 => Có 17 electron
- Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
- Điền các electron: 1s22s22p63s23p5
- Nguyên tố chlorine có 7 electron lớp ngoài cùng (lớp 3)
=> Nguyên tố phi kim
Em có thể trang 25 Hoá học 10: Viết được cấu hình electron nguyên tử của một số nguyên tố hóa học quen thuộc trong thực tế như: nitrogen, oxygen, aluminium… và dự đoán được tính chất hóa học cơ bản của chúng
Phương pháp giải:
Bước 1: Xác định số hiệu nguyên tử của mỗi nguyên tố
Bước 2: Viết cấu hình electron của mỗi nguyên tố
Bước 3: Dự đoán tính chất hóa học dựa vào số electron lớp ngoài cùng
+ Nguyên tử có 8 electron lớp ngoài cùng đều rất bền vững, hầu như không tham gia phản ứng hóa học
+ Nguyên tố mà nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là kim loại => Có tính chất của 1 kim loại
+ Nguyên tố mà nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng là phi kim => Có tính chất của 1 phi kim
+ Nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng có thể là kim loại hoặc phi kim
Lời giải:
- Nitrogen (Z = 7): 1s22s22p3
=> Nitrogen có 5 electron ở lớp ngoài cùng (lớp 2) => Là 1 phi kim và có tính chất hóa học của một phi kim
- Oxygen (Z = 8): 1s22s22p4
=> Oxygen có 6 electron ở lớp ngoài cùng (lớp 2) => Là 1 phi kim và có tính chất hóa học của một phi kim
- Aluminium (Z = 13): 1s22s22p63s23p1
=> Aluminium có 3 electron ở lớp ngoài cùng (lớp 3) => Là 1 kim loại và có tính chất hóa học của một kim loại
Lý thuyết Bài 3: Cấu trúc lớp vỏ electron nguyên tử
I. Chuyển động của electron trong nguyên tử
- Đến đầu thế kỉ XX, người ta vẫn cho rằng các electron chuyển động xung quanh hạt nhân nguyên tử theo những quỹ đạo tròn hay bầu dục, giống như quỹ đạo của các hành tinh xoay quanh mặt trời
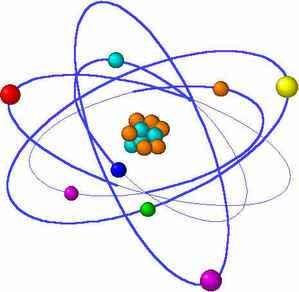
Mô hình hành tinh nguyên tử
- Mô hình hành tinh nguyên tử đã có ảnh hưởng rất lớn, thúc đẩy sự phát triển lý thuyết cấu tạo nguyên tử, nhưng không đầy đủ để giải thích nhiều tính chất của nguyên tử
- Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Tuy nhiên người ta vẫn có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất. Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là orbital nguyên tử. Orbital nguyên tử được kí hiệu là AO (Atomic orbital)
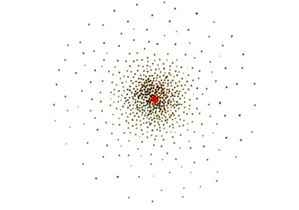
1. Hình dạng orbital nguyên tử
- Khi chuyển động trong nguyên tử, các electron có những mức năng lượng khác nhau đặc trưng cho trạng thái chuyển động của nó.
- Dựa trên sự khác về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, p, d và f. Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi
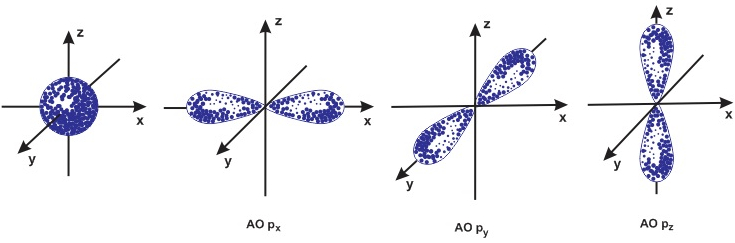
Hình dạng orbital s và p
2. Orbital
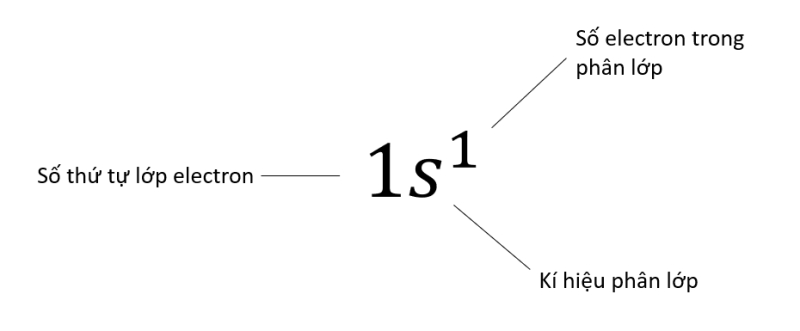
- Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital ![]()
- Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí Pauli). Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu có 2 electron thì biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước
II. Lớp và phân lớp electron
Trong nguyên tử, electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao
1. Lớp electron
- Những lớp electron ở lớp gần hạt nhân bị hút mạnh về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở xa hạt nhân
- Các electron thuộc cùng 1 lớp có mức năng lượng gần bằng nhau
- Người ta thường đánh số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3,…7 với tên gọi là các chữ cái in hoa như sau:

2. Phân lớp electron
- Các phân lớp trong mỗi electron được kí hiệu bằng các chữ cái viết thường, theo thứ tự s, p, d, f
- Các electron trên cùng 1 phân lớp có mức năng lượng bằng nhau
- Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
+ Lớp thứ nhất (lớp K, với n = 1) có 1 phân lớp, được kí hiệu là 1s
+ Lớp thứ 2 (lớp L, với n = 2) có 2 phân lớp, được kí hiệu là 2s và 2p
+ Lớp thứ 3 (lớp M, với n = 3) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d)
+ Lớp thứ 4 (lớp N, với n = 4) có 4 phân lớp, được kí hiệu là 4s, 4p, 4d, 4f
- Các electron ở phân lớp s gọi là electron s, các electron ở phân lớp p gọi là electron p
3. Số lượng orbital trong một phân lớp, trong một lớp
- Trong một phân lớp, các orbital có cùng mức năng lượng
+ Phân lớp s: có 1 AO s
+ Phân lớp p: có 3 AO px, py, pz
+ Phân lớp d: có 5 AO
+ Phân lớp f: có 7 AO
- Trong lớp electron thứ n có n2 AO (n ≤ 4)
Ví dụ: Lớp L (n = 2) có 2 phân lớp 2s và 2p. Trong đó phân lớp 2s có 1 AO, phân lớp 2p có 3 AO nên tổng số orbital trong lớp L là 1 + 3 = 4 hay 22 AO.
III. Cấu hình electron của nguyên tử
- Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau
- Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có năng lượng từ thấp đến cao (nguyên lí vững bền)
- Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (quy tắc Hund)
- Cấu hình electron của nguyên tử cho biết số lớp electron, thứ tự phân lớp electron trong mỗi lớp và phân lớp
1. Viết cấu hình electron của nguyên tử
- Bước 1: Xác định số electron trong nguyên tử.
- Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s…
- Bước 3: Điền các electron vào phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
Ví dụ: Viết cấu hình electron của nguyên tử oxygen (Z = 8)
- Tổng số electron của nguyên tử O là 8, viết thứ tự các lớp và phân lớp electron đến phân lớp 4s theo chiều tăng năng lượng.
- Điền các electron: 1s22s22p4, có thể thay 1s2 bằng kí hiệu [He].
- Electron cuối cùng điền vào phân lớp p nên oxygen là nguyên tố p
Cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn

2. Biểu diễn cấu hình electron theo ô orbital
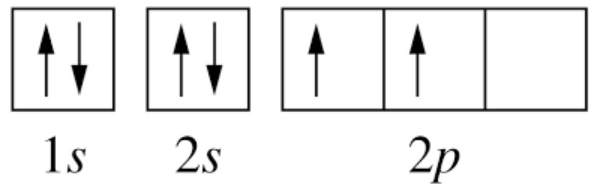
Ví dụ: Cấu hình electron của nguyên tử nitrogen có Z = 7: 1s22s22p3 có thể được biểu diễn theo ô orbital như sau:
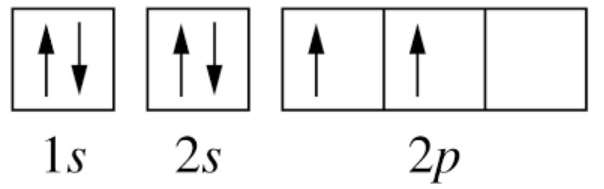
- 2 orbital 1s và 2s có đủ 2 electron được biểu diễn bằng 2 mũi tên ngược chiều nhau (nguyên lí Pauli). 3 electron còn lại được sắp xếp vào 3 ô orbital 2p bằng 3 mũi tên đi lên để số electron độc thân là tối đa (quy tắc Hund)
3. Đặc điểm của lớp electron ngoài cùng
- Các electron ngoài cùng quyết định tính chất hóa học cơ bản của nguyên tố (kim loại, phi kim, khí hiếm)
+ Các nguyên tử có 8 electron lớp ngoài cùng đều rất bền vững, hầu như không tham gia vào các phản ứng hóa học, đó là các nguyên tử khí hiếm (riêng He có số e lớp ngoài cùng là 2)
+ Các nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng là kim loại (trừ H, He, B)
+ Các nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là phi kim
+ Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hoá học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.