Toptailieu biên soạn và giới thiệu giải sách bài tập Hóa học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm các bài tập từ đó nâng cao kiến thức và biết cách vận dụng phương pháp giải vào các bài tập trong SBT Hóa học 10 Bài 6.
Nội dung bài viết
SBT Hóa học 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Bài 6.1 trang 15 sách bài tập Hóa học 10: Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Số lớp electron
B. Số electron ở lớp ngoài cùng
C. Nguyên tử khối
D. Số electron trong nguyên tử
Lời giải:
Đáp án đúng là: B
Các đại lượng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử gồm:
Số electron lớp ngoài cùng, bán kính nguyên tử, độ âm điện, tính kim loại – phi kim.
A. np2
B. ns2
C. ns2np2
D. ns2np4
Lời giải:
Đáp án đúng là: B
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn đều là ns2
Chú ý : Số electron hóa trị = số thứ tự nhóm (trừ He).
A. bán kính nguyên tử và độ âm điện đều giảm
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử tăng, độ âm điện giảm.
D. bán kính nguyên tử giảm, độ âm điện tăng.
Lời giải:
Đáp án đúng là: D
Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử bán kính nguyên tử giảm, độ âm điện tăng.
Bài 6.4 trang 15 sách bài tập Hóa học 10: Nguyên tố Y thuộc chu kì 4, nhóm IA của bảng tuần hoàn. Phát biểu nào sau đây về Y là đúng?
A. Y có độ âm điện lớn nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
B. Y có độ âm điện lớn nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4.
C. Y có độ âm điện nhỏ nhất và bán kính nguyên tử lớn nhất trong chu kì 4
D. Y có độ âm điện nhỏ nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4
Lời giải:
Đáp án đúng là: C
Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử bán kính nguyên tử giảm, độ âm điện tăng.
Y thuộc nhóm IA nên Y đứng đầu chu kì.
⇒ Y có độ âm điện nhỏ nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, bán kính nguyên tử giảm dần.
Lời giải:
Đáp án đúng là: B
Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần.
+ Tính kim loại tăng dần và tính phi kim giảm dần.
Bài 6.6 trang 15 sách bài tập Hóa học 10: Phát biểu nào sau đây không đúng?
A. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 19.
B. Nguyên tử có Z = 12 có bán kính lớn hơn nguyên tử có Z = 10.
C. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 13.
D. Các nguyên tố kim loại kiềm có bán kính nguyên tử lớn nhất trong chu kì.
Lời giải:
Đáp án đúng là: C
Chú ý:
- Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần.
+ Tính kim loại tăng dần và tính phi kim giảm dần.
A. Nguyên tử có Z = 11 và Z = 19 thuộc cùng nhóm A (số hiệu nguyên tử chênh nhau 8 nguyên tử).
⇒ Bán kính nguyên tử tăng dần
⇒Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 19.
⇒ Phát biểu A đúng.
B. Nguyên tử có Z = 12 và Z = 4 thuộc cùng nhóm A (số hiệu nguyên tử chênh nhau 8 nguyên tử). ⇒ Nguyên tử Z = 12 có bán kính lớn hơn nguyên tử có Z = 4. (1)
Nguyên tử có Z = 4 và Z = 10 thuộc cùng một chu kì ⇒ Nguyên tử có Z = 4 có bán kính lớn hơn nguyên tử có Z = 10. (2)
Từ (1) và (2) ⇒ Nguyên tử có Z = 12 có bán kính lớn hơn nguyên tử có Z = 10.
⇒ Phát biểu B đúng.
C. Nguyên tử có Z = 11 và Z = 13 thuộc cùng một chu kì
⇒ Bán kính nguyên tử giảm dần
⇒Nguyên tử có Z = 11 có bán kính lớn hơn nguyên tử có Z = 13.
⇒ Phát biểu C sai ⇒ Chọn C
D. Các nguyên tố kim loại kiềm đứng đầu chu kì nên có bán kính nguyên tử lớn nhất trong chu kì. ⇒ Phát biểu D đúng.
A. Li
B. Na
C. K
D. Cs
Lời giải:
Đáp án đúng là: A
Li (Z = 3), Na (Z = 11), K (Z = 19), Cs ( Z = 55) cùng thuộc nhóm IA
⇒ Bán kính Li < Na < K < Cs
Bài 6.8 trang 16 sách bài tập Hóa học 10: Phát biểu nào sau đây không đúng?
A. Nguyên tử có bán kính nhỏ nhất có Z = 1.
B. Kim loại yếu nhất trong nhóm IA có Z = 3.
C. Nguyên tố có độ âm điện lớn nhất có Z = 9.
D. Phi kim mạnh nhất trong nhóm VA có Z = 7.
Lời giải:
Đáp án đúng là: A
Chú ý:
- Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần.
+ Tính kim loại tăng dần và tính phi kim giảm dần.
A. Chu kì 1 có hai nguyên tố là H (Z = 1) và He (Z = 2).
⇒ He (Z = 2) có bán kính nhỏ hơn H (Z = 1)
⇒ Phát biểu A sai.
B. Kim loại đứng đầu nhóm IA là Li (Z = 3)
⇒ Li (Z = 3) là kim loại yếu nhất trong nhóm IA.
⇒ Phát biểu B đúng.
C. Nguyên tố có Z = 9 đứng đầu nhóm VIIA
⇒ Nguyên tố Z = 9 có độ âm điện lớn nhất trong bảng tuần hoàn.
⇒ Phát biểu C đúng.
D. Nguyên tố có Z = 7 là phi kim đứng đầu nhóm VA
⇒ Tính phi kim mạnh nhất trong nhóm VA
⇒ Phát biểu D đúng.
Bài 6.9 trang 16 sách bài tập Hóa học 10: Thứ tự tăng dần bán kính nguyên tử là
A. Li, Be, F, Cl
B. Be, Li, F, Cl
C. F, Be, Li, Cl
D. Cl, F, Li, Be
Lời giải:
Không có đáp án đúng.
Bài 6.10 trang 16 sách bài tập Hóa học 10: Cho các nguyên tố sau: 3Li, 8O, 9F, 11Na.
Dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là
A. F, O, Li, Na
B. F, Na, O, Li
C. F, Li, O, Na
D. Li, Na, O, F.
Lời giải:
Đáp án đúng là: A
3Li, 8O, 9F cùng thuộc chu kì 2. Trong một chu kì theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử giảm dần.
⇒ Sắp xếp theo chiều tăng dần bán kính nguyên tử: 9F < 8O < 3Li.
3Li và 11Na cùng thuộc nhóm IA. Trong một nhóm, theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử tăng dần.
⇒ Sắp xếp theo chiều tăng dần bán kính nguyên tử: 3Li < 11Na
Vậy dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là F, O, Li, Na.
Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. N, Si, Mg, K
B. Mg, K, Si, N
C. K, Mg, N, Si
D. K, Mg, Si, N
Lời giải:
Đáp án đúng là: D
Chú ý:
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử giảm dần.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử tăng dần.
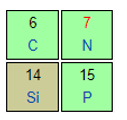
N và P thuộc cùng một nhóm ⇒ Bán kính nguyên tử: P > N
Si và P thuộc cùng một chu kì ⇒ Bán kính nguyên tử: Si > P
⇒ Bán kính nguyên tử Si > N (1)
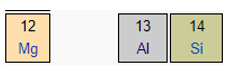
Mg và Si thuộc cùng một chu kì ⇒ Bán kính nguyên tử: Mg > Si (2)
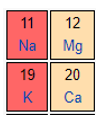
Mg và Ca thuộc cùng một nhóm ⇒ Bán kính nguyên tử: Ca > Mg
K và Ca thuộc cùng một chu kì ⇒ Bán kính nguyên tử: K > Ca
⇒ Bán kính nguyên tử: K > Mg (3)
Kết hợp (1), (2) và (3). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là K, Mg, Si, N
A. Mg < B < Al < N.
B. Mg < Al < B < N
C. B < Mg < Al < N
D. Al < B < Mg < N
Lời giải:
Đáp án đúng là: B
Chú ý:
Theo chiều tăng dần của điện tích hạt nhân:
- Trong một chu kì, độ âm điện tăng.
- Trong một nhóm, độ âm điện giảm.
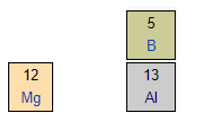
Mg và Al cùng thuộc một chu kì ⇒ Độ âm điện: Mg < Al
Al và B cùng thuộc một nhóm ⇒ Độ âm điện: Al < B
⇒ Độ âm điện Mg < Al < B (1)
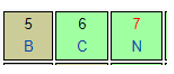
Lại có N và B cùng thuộc một chu kì ⇒ Độ âm điện B < N (2)
Kết hợp (1) và (2). Độ âm điện của các nguyên tố xếp theo chiều tăng dần là:
Mg < Al < B < N.
A. Cl > F > I > Br
B. I > Br > Cl > F
C. F > Cl > Br > I
D. I > Br > F > Cl
Lời giải:
Đáp án đúng là: C
F, Cl, Br, I cùng thuộc nhóm VIIA. Trong một nhóm, theo chiều điện tích hạt nhân tăng dần, độ âm điện giảm dần.
⇒Độ âm điện xếp theo chiều giảm dần là F > Cl > Br > I
A. Độ âm điện của X rất lớn và X là phi kim.
B. Độ âm điện của X rất nhỏ và X là phi kim.
C. Độ âm điện của X rất lớn và X là kim loại.
D. Độ âm điện của X rất nhỏ và X là kim loại.
Lời giải:
Đáp án đúng là: D
Giá trị của bán kính nguyên tử tỉ lệ nghịch với giá trị của độ âm điện.
Giá trị bán kính nguyên tử tỉ lệ thuận với tính kim loại và tỉ lệ nghịch với tính phi kim.
⇒ Nguyên tử của nguyên tố X có bán kính rất lớn thì độ âm điện rất nhỏ và X là kim loại
Bài 6.15 trang 17 sách bài tập Hóa học 10: Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 14. Thứ tự tính phi kim tăng dần của các nguyên tố đó là
A. X < Z < Y
B. Z < X < Y
C. Z < Y < X
D. Y < X < Z
Lời giải:
Đáp án đúng là: B
Chú ý: Theo chiều tăng dần điện tích hạt nhân nguyên tử:
- Trong một chu kì, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm, tính kim loại tăng dần và tính phi kim giảm dần.
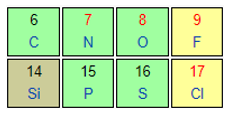
X và Y cùng thuộc một chu kì ⇒ Tính phi kim X < Y
X và Z cùng thuộc một nhóm ⇒ Tính phi kim Z < X
Thứ tự tính phi kim tăng dần của các nguyên tố được sắp xếp là: Z < X < Y
A. N, P, As, Bi
B. F, Cl, Br, I
C. C, Si, Ge, Sn
D. Te, Se, S, O
Lời giải:
Đáp án đúng là: D
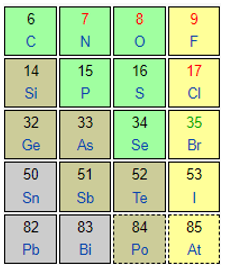
A. N, P, As, Bi thuộc cùng một nhóm.
Tính phi kim tăng dần theo chiều Bi < As < P < N.
⇒ A sai.
B. F, Cl, Br, I thuộc cùng một nhóm.
Tính phi kim tăng dần theo chiều I < Br < Cl < F.
⇒ B sai.
C. C, Si, Ge, Sn thuộc cùng một nhóm.
Tính phi kim tăng dần theo chiều Sn < Ge < Si < C.
⇒ C sai.
D. Te, Se, S, O thuộc cùng một nhóm.
Tính phi kim tăng dần theo chiều Te < Se < S < O
⇒ D đúng.
Bài 6.17 trang 17 sách bài tập Hóa học 10: Trong bảng tuần hoàn, hai nguyên tố X và Y có cùng số thứ tự nhóm. X thuộc nhóm A và Y thuộc nhóm B. So sánh số electron hóa trị và tính chất của X, Y. Minh họa bằng nguyên tố Cl và Mn ở nhóm VII.
Lời giải:
- Sự giống nhau: trong cùng một nhóm, các nguyên tử của nguyên tố nhóm A và B đều có số electron hóa trị bằng nhau nên có hóa trị cao nhất bằng nhau.
- Sự khác nhau: số electron lớp ngoài cùng và cấu hình electron của các nguyên tố nhóm A và B không giống nhau nên tính chất vật lí, hóa học của chúng cũng khác nhau.
Ví dụ: Cấu hình electron: 17Cl: [Ne]3s23p5 (nhóm VIIA) và 25Mn: [Ar]3d54s2 (nhóm VIIB).
+ Cl và Mn đều có 7 electron hóa trị nên đều có hóa trị cao nhất là 7 và số oxi hóa dương cao nhất +7.
+ 7 electron hóa trị của Cl là electron s, p còn 7 electron hóa trị của Mn là electron s, d.
+ Nguyên tử Cl có 7 electron lớp ngoài cùng, nguyên tử Mn chỉ có 2 electron lớp ngoài cùng.
+ Nguyên tố chlorine là phi kim điển hình còn nguyên tố manganese là kim loại chuyển tiếp.
Bài 6.18 trang 17 sách bài tập Hóa học 10: Cho cấu hình electron của nguyên tử hai nguyên tố sau:
X: 1s22s22p63s23p3
Y: 1s22s22p63s23p63d34s2
a) X, Y có ở trong cùng một nhóm nguyên tố không? Giải thích.
b) X, Y cách nhau bao nhiêu nguyên tố hóa học? Có cùng chu kì không?
Lời giải:
a) Nguyên tử X, Y đều có 5 electron hóa trị nên chúng ở cùng nhóm V.
Nguyên tử X có 5 electron lớp ngoài cùng, là nguyên tố p, thuộc nhóm VA.
Nguyên tử Y có 5 electron ở lớp ngoài cùng và sát lớp ngoài cùng, là nguyên tố d, thuộc nhóm VB.
b) X có 15 electron = số hiệu nguyên tử nguyên tố X.
Y có 23 electron = số hiệu nguyên tử nguyên tố Y
⇒ Chúng cách nhau 23 – 15 = 8 nguyên tố.
Nguyên tử X có 3 lớp electron ⇒ thuộc chu kì 3.
Nguyên tử Y có 4 lớp electron ⇒ thuộc chu kì 4.
Bài 6.19 trang 17 sách bài tập Hóa học 10: Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Hãy sắp xếp các nguyên tố trên theo chiều giảm dần bán kính nguyên tử.
Lời giải:
Liên hệ giữa các nguyên tố đó trong bảng tuần hoàn được mô tả trong bảng sau:
|
7N |
||||
|
12Mg
|
14Si |
|||
|
19K |
Bán kính nguyên tử: K > Mg, Si > N
Theo chu kì, bán kính nguyên tử giảm từ trái qua phải: Mg > Si.
Thứ tự giảm dần bán kính nguyên tử: K > Mg > Si > N.
Bài 6.20 trang 17 sách bài tập Hóa học 10: Cho các nguyên tố X, T, Z và T với số hiệu nguyên tử lần lượt là 9, 17, 33 và 35. Hãy sắp xếp thứ tự tăng dần độ âm điện và giải thích.
Lời giải:
Liên hệ giữa các nguyên tố đó trong bảng tuần hoàn được mô tả trong bảng sau:
|
9X |
||||
|
17Y
|
||||
|
33Z |
35T |
Độ âm điện tăng dần: Z < T < Y < X.
Giải thích: theo nhóm A, độ âm điện giảm dần từ trên xuống dưới nên ta có:
9X > 17Y > 35T.
Theo chu kì, độ âm điện tăng dần từ trái qua phải nên ta có: 33Z < 35T.
Bài 6.21 trang 17 sách bài tập Hóa học 10: Cho các nguyên tố cùng thuộc chu kì 3: 11Na, 13Al và 17Cl và các giá trị độ âm điện là 3,16; 1,61; 0,93. Hãy gán mỗi giá trị độ âm điện cho mỗi nguyên tố và giải thích
Lời giải:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần.
Các giá trị độ âm điện tương ứng: 11Na (0,93); 13Al (1,61) và 17Cl (3,16)
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Xếp các nguyên tố đó theo thứ tự độ âm điện giảm dần.
d) Xếp các nguyên tố đó theo thứ tự tính phi kim tăng dần.
Lời giải:
a) Cấu hình electron:
6X: 1s22s22p2
9Y: 1s22s22p5
14Z: 1s22s22p63s23p2
6X và 9Y thuộc chu kì 2 và 14Z thuộc chu kì 3.
9Y thuộc nhóm VIIA, 6X thuộc nhóm IVA, 14Z thuộc nhóm IVA.
b) X và Y cùng thuộc chu kì 2, ZX < ZY
⇒ Bán kính nguyên tử của X > Y.
X và Z cùng thuộc nhóm IVA, ZX < ZZ
⇒ Bán kính nguyên tử Z > X
Vậy bán kính nguyên tử tăng dần là Y < X < Z
c) X và Y cùng thuộc chu kì 2, ZX < ZY
⇒ Độ âm điện của X < Y
X và Z cùng thuộc nhóm IVA, ZX < ZZ
⇒ Độ âm điện của Z < X.
Vậy thứ tự độ âm điện giảm dần là Y > X > Z
d) Thứ tự tính phi kim tăng dần là Z < X < Y.
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Gán các giá trị độ âm điện (0,82; 1,31 và 0,93) cho X, Y, Z.
d) Xếp các nguyên tố đó theo thứ tự tính kim loại giảm dần.
Lời giải:
a) Cấu hình electron:
11X: 1s22s22p63s1
13Y: 1s22s22p63s23p1
19Z: 1s22s22p63s23p64s1
11X và 13Y thuộc chu kì 3 và 19Z thuộc chu kì 4.
11X thuộc nhóm IA, 13Y thuộc nhóm IIIA và 19Z thuộc nhóm IA.
b) X và Y cùng thuộc chu kì 3, ZX < ZY
⇒ Bán kính nguyên tử của X > Y.
X và X cùng thuộc nhóm IA, ZX < ZZ
⇒ Bán kính nguyên tử Z > X.
Vậy thứ tự bán kính nguyên tử tăng dần là Y < X < Z
c) X và Y cùng thuộc chu kì 3, ZX < ZY
⇒ Độ âm điện của X < Y.
X và Z cùng thuộc nhóm IA, ZX < ZZ
⇒ Độ âm điện của Z < X
Vậy độ âm điện Y (1,31); X (0,93); Z (0,82)
d) Thứ tự tính kim loại giảm dần là Z > X > Y
Bài 6.24 trang 17 sách bài tập Hóa học 10: So sánh tính kim loại của các nguyên tố: Al, Ca, Rb
Lời giải:
Bước 1: Xác định vị trí (chu kì, nhóm) trong bảng tuần hoàn và xếp các nguyên tố vào trong bảng: Al (3, IIIA); Ca (4, IIA); Rb (5, IA).
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
|
3 |
Al |
||
|
4 |
K (*) |
Ca |
Ga (*) |
|
5 |
Rb |
Bước 2: Chọn các nguyên tố trung gian: Ga cùng nhóm với Al và cùng chu kì với Ca; K cùng nhóm với Rb và cùng chu kì với Ca.
Bước 3: Dựa vào xu hướng biến đổi tính kim loại và tính phi kim của các nguyên tố trong chu kì và nhóm A để so sánh tính chất của chúng.
- So sánh Al và Ga: từ trên xuống trong nhóm IIIA, tính kim loại tăng dần
⇒ Tính kim loại Ga > Al.
- So sánh K, Ca và Ga: từ trái qua phải trong chu kì, tính kim loại giảm dần
⇒ Tính kim loại K > Ca > Ga.
- So sánh K và Rb: từ trên xuống trong nhóm IA, tính kim loại tăng dần
⇒ Tính kim loại Rb > k
Vậy tính kim loại Rb > Ca > Al.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.