Với giải Hoạt động trang 109 Hóa học lớp 10 Kết nối tri thức chi tiết trong Bài 21: Nhóm halogen giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Tìm hiểu tính tẩy màu của khí chlorine ẩm
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
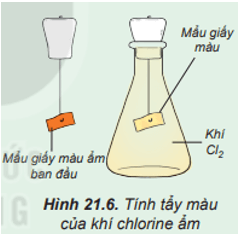 Quan sát hiện tượng và thực hiện yêu cầu sau:
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích.
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hoá - tự khử trong phản ứng này?
Lời giải:
1. Sau khi cho mẩu giấy màu ẩm vào bình tam giác thì mẩu giấy mất màu do một phần khí Cl2 tác dụng với nước sinh ra HClO có tính oxi hóa mạnh, có khả năng diệt khuẩn và tẩy màu.
Cl2 + H2O ⇌ HCl + HClO
2. Trong phản ứng của chlorine với nước thì chlorine vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Ta nói chlorine tự oxi hoá - tự khử trong phản ứng này vì trong phân tử chlorine có một nguyên tử Cl đóng vai trò là chất oxi hóa, một nguyên tử Cl đóng vai trò là chất khử.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 104 Hóa học 10: Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn sao tại ở cả dạng đơn chất và hợp chất...
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên...
Hoạt động 1 trang 105 Hóa học 10: Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen...
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy...
Hoạt động 1 trang 106 Hóa học 10: Xác định số oxi hoá của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4...
Hoạt động 2 trang 106 Hóa học 10: Từ các số oxi hoá của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?...
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế...
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích...
Câu hỏi 5 trang 108 Hóa học 10: Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron...
Hoạt động trang 108 Hóa học 10: Xét các phản ứng hoá học: H2(g) + X2(g) → 2HX(g) (X là các halogen)...
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt...
Câu hỏi 7 trang 110 Hóa học 10: Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride, sodium chlorate và nước...
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide...
Câu hỏi 8 trang 110 Hóa học 10: Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2...
Câu hỏi 9 trang 111 Hóa học 10: Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành ở cực dương...
Em có thể trang 111 Hóa học 10: Thực hiện được thí nghiệm chứng minh và so sánh tính oxi hoá của đơn chất halogen...
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 104 Hóa học 10: Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn sao tại ở cả dạng đơn chất và hợp chất..
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên...
Hoạt động 1 trang 105 Hóa học 10: Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen..
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy...
Hoạt động 1 trang 106 Hóa học 10: Xác định số oxi hoá của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4...
Hoạt động 2 trang 106 Hóa học 10: Từ các số oxi hoá của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?...
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế...
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích...
Câu hỏi 5 trang 108 Hóa học 10: Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron.
Hoạt động trang 108 Hóa học 10: Xét các phản ứng hoá học: H2(g) + X2(g) → 2HX(g) (X là các halogen)...
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt...
Hoạt động trang 109 Hóa học 10:Tìm hiểu tính tẩy màu của khí chlorine ẩm...
Câu hỏi 7 trang 110 Hóa học 10: Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride, sodium chlorate và nước...
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide...
Câu hỏi 8 trang 110 Hóa học 10: Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2...
Câu hỏi 9 trang 111 Hóa học 10: Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành ở cực dương...
Em có thể trang 111 Hóa học 10: Thực hiện được thí nghiệm chứng minh và so sánh tính oxi hoá của đơn chất halogen....
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 20: Ôn tập chương VI
Bài 22: Hydrogen halide. Muối halide
Bài 23: Ôn tập chương VII
Bài 1: Thành phần của nguyên tử
Bài 2: Nguyên tố hoá học
 Quan sát hiện tượng và thực hiện yêu cầu sau:
Quan sát hiện tượng và thực hiện yêu cầu sau: