Toptailieu biên soạn và giới thiệu giải sách bài tập Hóa học 10 Bài 21: Nhóm halogen sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm các bài tập từ đó nâng cao kiến thức và biết cách vận dụng phương pháp giải vào các bài tập trong SBT Hóa học 10 Bài 21.
SBT Hóa học 10 Kết nối tri thức Bài 21: Nhóm halogen
Câu hỏi trang 65 SBT Hóa học 10
A. 5.
B. 7.
C. 2.
D. 8.
Phương pháp giải:
Dựa vào vị trí của các nguyên tố halogen:
- Nhóm VIIA → Có 7 electron lớp ngoài cùng
Lời giải:
- Đáp án: B
Bài 21.2 trang 65 SBT Hóa học 10: Tính chất hoá học đặc trưng của các đơn chất halogen là
A. tính khử.
B. tính base.
C. tính acid.
D. tính oxi hoá.
Phương pháp giải:
Dựa vào vị trí của các nguyên tố halogen:
- Nhóm VIIA → là nhóm có độ âm điện cao nhất xét theo từng chu kì
Lời giải:
- Đáp án: D
A. Na3AlF6.
B. NaF.
C. HF.
D. CaF2.
Lời giải:
- Đáp án: D
Bài 21.4 trang 65 SBT Hóa học 10: Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là
A. F2.
B. Br2.
C. I2.
D. Cl2.
Lời giải:
- Đáp án: C
Bài 21.5 trang 65 SBT Hóa học 10: Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%?
A. NaCl.
B. KCl.
C. MgCl2.
D. NaF.
Lời giải:
- Đáp án: A
A. -1.
B. +7.
C. +5.
D. +1.
Phương pháp giải:
Dựa vào vị trí của các nguyên tố halogen:
- Nhóm VIIA → Số oxi hóa cao nhất là +7
Lời giải:
- Đáp án: B
Bài 21.7 trang 65 SBT Hóa học 10: Các nguyên tố halogen thuộc nhóm nào trong bảng tuần hoàn
A. VIIIA.
B. VIA.
C. VIIA.
D. IIA.
Lời giải:
- Đáp án: C
Bài 21.8 trang 65 SBT Hóa học 10: Trong nhóm halogen, đơn chất có tính oxi hóa mạnh nhất là
A. F2.
B Cl2.
C. Br2.
D. I2.
Phương pháp giải:
Dựa vào chiều biến đổi độ âm điện của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải:
- Đáp án: A
- Giải thích: Fluorine là nguyên tố đứng đầu nhóm VIIA → Độ âm điện cao nhất
→ Tính oxi hóa mạnh nhất
A. F2.
B Cl2.
C. Br2.
D. I2
Lời giải:
- Đáp án: D
Bài 21.10 trang 65 SBT Hóa học 10: Halogen nào sau đây được dùng để khử trùng nước sinh hoạt?
A. F2.
B. Cl2.
C. Br2.
D. I2.
Lời giải:
- Đáp án: B
- Giải thích: Do chlorine sẽ phản ứng một phần với nước tạo thành HCl và HClO. Trong đó HClO có tính oxi hóa mạnh → Nước chlorine có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt
A. Tuyến thượng thận.
B. Tuyến tụy.
C. Tuyến yên.
D. Tuyến giáp trạng.
Lời giải:
- Đáp án: D
Bài 21.12 trang 65 SBT Hóa học 10: Trong dãy halogen, nguyên tử có độ âm điện nhỏ nhất là
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
Phương pháp giải:
Dựa vào chiều biến đổi độ âm điện của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải:
- Đáp án: D
- Giải thích: Do iodine đứng cuối trong 4 nguyên tố trên ở nhóm VIIA
Câu hỏi trang 66 SBT Hóa học 10
A. Giảm dần.
B. Không đổi.
C. Tăng dần.
D. Tuần hoàn.
Phương pháp giải:
Dựa vào chiều biến đổi bán kính nguyên tử của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
Lời giải:
- Đáp án: C
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
Phương pháp giải:
Dựa vào chiều biến đổi độ âm điện của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải:
- Đáp án: D
- Giải thích: Do iodine đứng cuối trong 4 nguyên tố trên ở nhóm VIIA → độ âm điện thấp nhất → Xu hướng nhận 1 electron yếu nhất
A. Giảm dần.
B. Tăng dần.
C. Không đổi.
D. Tuần hoàn
Phương pháp giải:
Dựa vào phân tử khối của các chất trong VIIA: phân tử khối tăng dần theo thứ tự: F2 đến I2
Lời giải:
- Đáp án: B
Bài 21.16 trang 66 SBT Hóa học 10: Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là
A. F2.
B Cl2.
C. Br2.
D. I2.
Lời giải:
- Đáp án: A
- Cụ thể:
![]()
A. Nhường 1 electron.
B. Nhận 1 electron.
C. Nhường 7 electron.
D. Góp chung 1 electron.
Phương pháp giải:
Dựa vào tính chất của kim loại: tính khử
Lời giải:
- Vì kim loại có tính khử → xu hướng nhường electron để tạo thành cấu hình của khí hiếm → Nguyên tử halogen nhận 1 electron để tạo thành cấu hình của khí hiếm
→ Đáp án: B
Bài 21.18 trang 66 SBT Hóa học 10: Hít thở không khí có chứa khi nào sau đây vượt ngưỡng 30 µg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở?
A. O2.
B. Cl2.
C. N2.
D. O3.
Lời giải:
- Đáp án: B
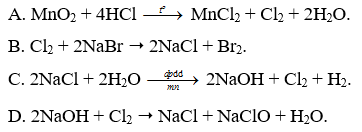
Phương pháp giải:
Trong công nghiệp, chlorine được sản xuất bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn
Lời giải:
- Đáp án: C
Bài 21.20 trang 66 SBT Hóa học 10: Chỉ thị nào sau đây thường dùng để nhận biết dung dịch I2?
A. Phenolphtalein.
B. Hồ tinh bột.
C. Quỳ tím.
D. Nước vôi trong.
Phương pháp giải:
Dựa vào tính chất của I2 khi kết hợp với hồ tinh bột " hợp chất màu xanh tím
Lời giải:
- Đáp án: B
Câu hỏi trang 67 SBT Hóa học 10
Bài 21.21 trang 67 SBT Hóa học 10: Thực nghiệm cho thấy các phản ứng: H2(g) + X2(g) → 2HX(g) trong dãy halogen xảy ra với mức độ giảm dần từ F2 đến I2. Biến thiên enthalpy của các phản ứng thay đổi như thế nào trong dãy trên?
Phương pháp giải:
Dựa vào mức độ phản ứng của các halogen với H2: Halogen phản ứng càng mạnh → biến thiên enthalpy càng thấp
Lời giải:
- F2 phản ứng với H2 ngay trong bóng tối và nhiệt độ thấp, phản ứng gây nổ mạnh
→ biến thiên enthalpy thấp nhất
- I2 phản ứng với H2 cần xúc tác Pt và nhiệt độ cao, phản ứng thuận nghịch
→ biến thiên enthalpy cao nhất
→ Biến thiên enthalpy của các phản ứng trên tăng dần theo dãy F2 đến I2
Bài 21.22 trang 67 SBT Hóa học 10: Đốt cháy hoàn toàn 0,48 g kim loại M (hoá trị II) bằng khí chlorine, thu được 1,332 g muối chloride. Xác định kim loại M.
Phương pháp giải:
- Bước 1: Bảo toàn khối lượng →
- Bước 2: Tìm theo phương trình phản ứng
- Bước 3: Tìm nguyên tử khối của M
Lời giải:
- Bảo toàn khối lượng cho phản ứng ta có:
→ mol
- Xét phương trình hóa học: M + Cl2 → MCl2
→ mol
→ → M là calcium (Ca)
Bài 21.23 trang 67 SBT Hóa học 10: Nung nóng một bình bằng thép có chứa 0,04 mol H2 và 0,04 mol Cl2 để thực hiện phản ứng, thu được 0,072 mol khí HCl.
a) Tính hiệu suất của phản ứng tạo thành HCl.
b) Ở cùng nhiệt độ thường, áp suất khí trong bình trước và sau phản ứng lần lượt là P1 và P2. Hãy so sánh P1 và P2.
Lời giải:
a) Xét phương trình phản ứng: H2 + Cl2 2HCl
Ban đầu: 0,04 0,04 (mol)
Phản ứng: 0,036 ← 0,036 ← 0,072 (mol)
Sau phản ứng: 0,004 0,004 0,072 (mol)
-> Hiệu suất phản ứng là:
b) Nhận thấy mol và mol
→ → P1 = P2
Bài 21.24 trang 67 SBT Hóa học 10: Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối X của potassium (K). Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng. Nhỏ vài giọt nước Br2 vào ống thứ hai, lắc đều rồi thêm hồ tinh bột, thấy có màu xanh tím. Xác định công thức hoá học của X và viết phương trình hóa học của các phản ứng.
Lời giải:
- Sau khi thêm hồ tinh bột thấy có màu xanh tím → chứng tỏ sau phản ứng có sinh ra I2 → Muối là KI
- Các phương trình phản ứng:
KI + AgNO3 → KNO3 + AgI (vàng)
2KI + Br2 → 2KBr + I2
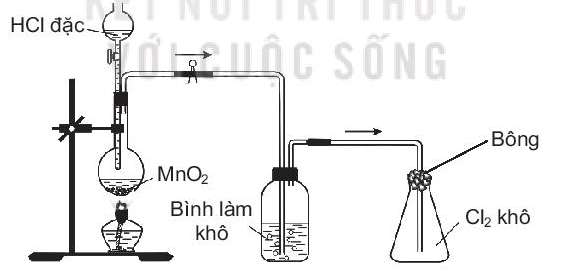
Hãy đề xuất một dung dịch để sử dụng cho từng mục đích sau:
a) Cho vào bình làm khô để làm khô khí Cl2.
b) Tẩm vào bông đậy bình thu khí để hạn chế khí Cl2 bay ra. Giải thích và viết phương trình hoá học minh hoạ nếu có
Phương pháp giải:
Dựa vào
a) Để làm khô 1 chất thì chất sử dụng cần có các đặc điểm sau:
- Có khả năng hút nước
- Không được phản ứng với chất cần làm khô
b) Chất cần tẩm vào bông đậy bình thu khí để hạn chế khí Cl2 bay ra cần có đặc điểm: Phản ứng được với khí Cl2
Lời giải:
a) Nên chọn các chất sau để làm khô khí Cl2: H2SO4 đặc, P2O5,…
b) Nên chọn các chất sau để hạn chế khí Cl2 bay ra: NaOH, KOH,…
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.