Toptailieu biên soạn và giới thiệu giải sách bài tập Hóa học 10 Bài 22: Hydrogen halide. Muối halide sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm các bài tập từ đó nâng cao kiến thức và biết cách vận dụng phương pháp giải vào các bài tập trong SBT Hóa học 10 Bài 22.
SBT Hóa học 10 Kết nối tri thức Bài 22: Hydrogen halide. Muối halide
Câu hỏi trang 68 SBT Hóa học 10
A. HCl.
B. HI.
C. HF.
D. HBr.
Phương pháp giải:
Dựa vào định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải:
- Đáp án: C
A. HCl.
B. HBr.
C. HF.
D. HI.
Phương pháp giải:
Dựa vào phân tử nào có liên kết hydrogen -> Nhiệt độ sôi và nhiệt độ nóng chảy cao hơn.
Lời giải:
- Đáp án: C
A. Tăng dần.
B. Giảm dần.
C. Không đổi.
D. Tuần hoàn.
Phương pháp giải:
Dựa vào bán kính nguyên tử của nhóm halogen tăng dần từ fluorine đến iodine → khoảng cách giữa nguyên tử H và nguyên tử halogen tăng dần →nguyên tử H có độ linh động tăng dần → độ bền liên kết giảm dần
Lời giải:
- Đáp án: B
Bài 22.4 trang 68 SBT Hóa học 10: Dung dịch hydrohalic acid nào sau đây có tính acid yếu?
A. HF.
B. HBr.
C. HCl.
D. HI.
Phương pháp giải:
Dựa vào bán kính nguyên tử của nhóm halogen tăng dần từ fluorine đến iodine → khoảng cách giữa nguyên tử H và nguyên tử halogen tăng dần → nguyên tử H có độ linh động tăng dần → tính acid càng mạnh
Lời giải:
- Đáp án: A
A. HCl.
B. NaBr.
C. NaCl.
D. HF.
Phương pháp giải:
Dựa vào màu sắc kết tủa của muốn silver với ion halide:
- AgCl: kết tủa trắng
- AgBr: kết tủa vàng nhạt
- AgI: kết tủa vàng
Lời giải:
- Đáp án: B
A. FeCl3 và H2.
B. FeCl2 và Cl2.
C. FeCl3 và Cl2.
D. FeCl2 và H2.
Lời giải:
- Đáp án: D
- Cụ thể: Fe + 2HCl → FeCl2 + H2
A. HBr.
B. HF.
C. HI.
D. HCl.
Lời giải:
- Đáp án: D
A. HF.
B. HCl.
C. HBr.
D. HI.
Phương pháp giải:
Dựa vào công thức của hợp chất teflon là -(CF2-CF2)-n để dự đoán
Lời giải:
- Đáp án: A
A. NaOH.
B. HCl.
C. AgNO3.
D. KNO3.
Phương pháp giải:
Phân biệt các ion F-, Cl-, Br-, I- bằng cách cho dung dịch AgNO3 vào dung dịch muối của chúng
Lời giải:
- Đáp án: B
|
Halide ion Thuốc thử |
F- |
Cl- |
Br- |
I- |
|
Dung dịch AgNO3 |
Không hiện tượng |
Có kết tủa trắng (AgCl) |
Có kết tủa vàng nhạt (AgBr) |
Có kết tủa vàng (AgI) |
Bài 22.10 trang 68 SBT Hóa học 10: KBr thể hiện tính khử khi đun nóng với dung dịch nào sau đây?
A. AgNO3.
B. H2SO4 đặc.
C. HCl.
D. H2SO4 loãng.
Phương pháp giải:
Để thể hiện tính khử cần có chất có tính oxi hóa.
Lời giải:
- Đáp án: B
Câu hỏi trang 69 SBT Hóa học 10
A. Tương tác van der Waals tăng dần.
B. Phân tử khối tăng dần
C. Độ bền liên kết giảm dần.
D. Độ phân cực liên kết giảm dần.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải:
- Đáp án: A
A. Tuần hoàn.
B. Tăng dần.
C. Giảm dần.
D. Không đổi.
Phương pháp giải:
Dựa vào độ âm điện của nhóm halogen giảm dần từ fluorine đến iodine → độ phân cực của liên kết với hydrogen sẽ giảm dần
Lời giải:
- Đáp án: C
A. NaHCO3.
B. CaCO3.
C. NaOH.
D. MnO2.
Phương pháp giải:
Để thể hiện tính khử cần có chất có tính oxi hóa
Lời giải:
- Đáp án: D
A. FeCO3.
B. Fe.
C. Fe(OH)2.
D. Fe2O3.
Phương pháp giải:
Để thể hiện tính oxi hóa cần có chất có tính khử.
Lời giải:
- Đáp án: B
Bài 22.15 trang 69 SBT Hóa học 10: Thuốc thử nào sau đây phân biệt được hai dung dịch HCl và NaCl?
A. Phenolphthalein.
B. Hồ tinh bột.
C. Quỳ tím.
D. Nước bromine.
Lời giải:
- Đáp án: C
- Giải thích: dung dịch HCl làm quỳ tím chuyển đỏ và dung dịch NaCl không làm quỳ tím đổi màu
A. SiO2 + 4HF → SiF4 + 2H2O.
B. NaOH + HF → NaF + H2O.
C. H2 + F2 → 2HF.
D. 2F2 + 2H2O → 4HF + O2.
Lời giải:
- Đáp án: A
A. tương tác van der Waals tăng dần.
B. độ phân cực liên kết giảm dần.
C. phân tử khối tăng dần.
D. độ bền liên kết giảm dần.
Phương pháp giải:
Dựa vào bán kính nguyên tử của nhóm halogen tăng dần từ fluorine đến iodine → khoảng cách giữa nguyên tử H và nguyên tử halogen tăng dần → nguyên tử H có độ linh động tăng dần → tính acid càng mạnh
Lời giải:
- Đáp án: D
A. KBr.
B. KI.
C. NaCl.
D. NaBr.
Phương pháp giải:
Để tác dụng với một chất có tính oxi hóa mạnh mà chỉ xảy ra phản ứng trao đổi → chất tác dụng không có tính khử hoặc tính khử rất yếu
Lời giải:
- Đáp án: C
Câu hỏi trang 70 SBT Hóa học 10
Bài 22.19 trang 70 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Dung dịch hydrofluoric acid có khả năng ăn mòn thuỷ tinh.
B. NaCl rắn tác dụng với H2SO4 đặc, nóng, thu được hydrogen chloride.
C. Hydrogen chloride tan nhiều trong nước.
D. Lực acid trong dãy hydrohalic acid giảm dần từ HF đến HI.
Lời giải:
- Đáp án: D
- Giải thích: Lực acid trong dãy hydrohalic acid tăng dần từ HF đến HI
Bài 22.20 trang 70 SBT Hóa học 10: Dung dịch nào sau đây có thể phân biệt hai dung dịch NaF và NaCl?
A. HCl.
B. HF.
C. AgNO3.
D. Br2.
Lời giải:
- Đáp án: C
- Giải thích:
AgNO3 + NaCl → AgCl (kết tủa trắng) + NaNO3
AgNO3 không phản ứng với NaF vì AgF là muối tan
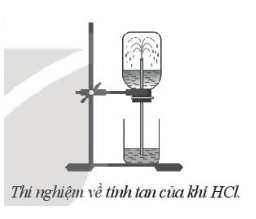
- Bước 1 chuẩn bị một bình khô chứa khí HCl, đậy bình bằng nút cao su có ống thuỷ tinh xuyên qua và một cốc nước.
- Bước 2: nhúng ống thuỷ tinh vào cốc nước, thấy nước phun vào bình (xem hình bên).
a) Hiện tượng nước phun vào bình cho thấy áp suất khí HCl trong bình đã tăng hay giảm rất nhanh. Giải thích
b) Sự biến đổi áp suất như vậy đã chứng tỏ tính chất gì của khí HCl?
Lời giải:
a) Hiện tượng nước phun vào bình chứng tỏ áp suất khí trong bình đã giảm rất nhanh
b) Sự giảm nhanh áp suất chứng tỏ khí hydrogen chloride đã tan nhanh trong nước
a) Một bệnh nhân bị đau dạ dày do dư thừa acid được kê đơn thuốc uống có chứa NaHCO3. Viết phản ứng minh hoạ tác dụng của thuốc.
b) Ở 37 °C, tinh bột bị thuỷ phân thành glucose trong môi trường acid (HCl) có xúc tác enzyme. Viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
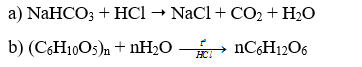
Bài 22.23 trang 70 SBT Hóa học 10: Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối của sodium. Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng nhạt. Nhỏ vài giọt nước Cl2 vào ống thứ hai, lắc nhẹ, thêm 1 mL benzene và lắc đều, thấy benzene từ không màu chuyển sang màu da cam. Xác định công thức của muối sodium và viết phương trình hoá học của các phản ứng xảy ra.
Phương pháp giải:
Dựa vào
- Màu sắc kết tủa của muốn silver với ion halide:
+ AgCl: kết tủa trắng
+ AgBr: kết tủa vàng nhạt
+ AgI: kết tủa vàng
- Tính chất của halogen: halogen mạnh đẩy halogen yếu ra khỏi muối
Lời giải:
- Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng nhạt
→ Muối của sodium là NaBr
NaBr + AgNO3 → NaNO3 + AgBr (kết tủa vàng nhạt)
- Benzene từ không màu chuyển sang màu da cam là do khi Br2 tan trong benzene xuất hiện màu da cam
2NaBr + Cl2 → 2NaCl + Br2
Một số kết quả thí nghiệm được ghi lại ở bảng sau.
|
Chất thử |
Thuốc thử |
Hiện tượng |
|
X |
Hồ tinh bột |
Xuất hiện màu xanh tím |
|
Z |
Baking soda, NaHCO3 |
Có bọt khí bay ra |
Các dung dịch ban đầu được kí hiệu tương ứng là
A. Z, Y, X.
B. Y, X, Z.
C. Y, Z, X.
D. X, Z, Y.
Phương pháp giải:
- X làm hồ tinh bột chuyển màu xanh tím → X là iodine
- Z tác dụng với NaHCO3 tạo bọt khí → Z là hydrochloric acid
NaHCO3 + HCl → NaCl + CO2 + H2O
- Và còn lại Y là sodium chlorine
Lời giải:
→ Đáp án: A
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.