Với giải Câu hỏi trang 66 SBT Hoá học10 Kết nối tri thức Bài 21: Nhóm halogen giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 66 Bài 21: Nhóm halogen
A. Giảm dần.
B. Không đổi.
C. Tăng dần.
D. Tuần hoàn.
Phương pháp giải:
Dựa vào chiều biến đổi bán kính nguyên tử của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
Lời giải:
- Đáp án: C
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
Phương pháp giải:
Dựa vào chiều biến đổi độ âm điện của các nguyên tố trong cùng một nhóm:
- Trong cùng 1 nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải:
- Đáp án: D
- Giải thích: Do iodine đứng cuối trong 4 nguyên tố trên ở nhóm VIIA → độ âm điện thấp nhất → Xu hướng nhận 1 electron yếu nhất
A. Giảm dần.
B. Tăng dần.
C. Không đổi.
D. Tuần hoàn
Phương pháp giải:
Dựa vào phân tử khối của các chất trong VIIA: phân tử khối tăng dần theo thứ tự: F2 đến I2
Lời giải:
- Đáp án: B
Bài 21.16 trang 66 SBT Hóa học 10: Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là
A. F2.
B Cl2.
C. Br2.
D. I2.
Lời giải:
- Đáp án: A
- Cụ thể:
![]()
A. Nhường 1 electron.
B. Nhận 1 electron.
C. Nhường 7 electron.
D. Góp chung 1 electron.
Phương pháp giải:
Dựa vào tính chất của kim loại: tính khử
Lời giải:
- Vì kim loại có tính khử → xu hướng nhường electron để tạo thành cấu hình của khí hiếm → Nguyên tử halogen nhận 1 electron để tạo thành cấu hình của khí hiếm
→ Đáp án: B
Bài 21.18 trang 66 SBT Hóa học 10: Hít thở không khí có chứa khi nào sau đây vượt ngưỡng 30 µg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở?
A. O2.
B. Cl2.
C. N2.
D. O3.
Lời giải:
- Đáp án: B
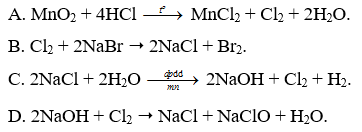
Phương pháp giải:
Trong công nghiệp, chlorine được sản xuất bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn
Lời giải:
- Đáp án: C
Bài 21.20 trang 66 SBT Hóa học 10: Chỉ thị nào sau đây thường dùng để nhận biết dung dịch I2?
A. Phenolphtalein.
B. Hồ tinh bột.
C. Quỳ tím.
D. Nước vôi trong.
Phương pháp giải:
Dựa vào tính chất của I2 khi kết hợp với hồ tinh bột " hợp chất màu xanh tím
Lời giải:
- Đáp án: B
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 21.2 trang 65 SBT Hóa học 10: Tính chất hoá học đặc trưng của các đơn chất halogen là...
Bài 21.5 trang 65 SBT Hóa học 10: Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%?...
Bài 21.7 trang 65 SBT Hóa học 10: Các nguyên tố halogen thuộc nhóm nào trong bảng tuần hoàn..
Bài 21.8 trang 65 SBT Hóa học 10: Trong nhóm halogen, đơn chất có tính oxi hóa mạnh nhất là..
Bài 21.10 trang 65 SBT Hóa học 10: Halogen nào sau đây được dùng để khử trùng nước sinh hoạt?...
Bài 21.12 trang 65 SBT Hóa học 10: Trong dãy halogen, nguyên tử có độ âm điện nhỏ nhất là..
Bài 21.20 trang 66 SBT Hóa học 10: Chỉ thị nào sau đây thường dùng để nhận biết dung dịch I2?...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.