Với giải Câu hỏi trang 58 SGK Hoá học10 Chân trời sáng tạo trong Bài 9: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Chân trời sáng tạo trang 58 Bài 9: Liên kết ion
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Lời giải:
Đáp án đúng là: B
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
A. 4
B. 2
C. 1
D. 3
Lời giải:
Đáp án đúng là: D
- Cấu hình electron của nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2
Nguyên tử Ca nhường 2 electron tạo thành ion Ca2+ có cấu hình electron là:
1s22s22p6 3s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử F (Z = 9): 1s22s22p5
Nguyên tử F nhận 1 electron tạo thành ion F- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1
Nguyên tử Al nhường 3 electron tạo thành ion Al3+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3
Nguyên tử N nhận 3 electron tạo thành ion N3- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Vậy có 3 ion là F-, Al3+ và N3- có cấu hình electron giống với cấu hình electron của khí hiếm Ne.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
Lời giải:
a) – Potassium (K, Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1
Nguyên tử K nhường 1 electron tạo thành ion K+ có cấu hình electron là: 1s22s22p63s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Không có hợp chất ion nào chỉ tạo bởi các ion K+ và Mg2+ với nhau vì hai ion này cùng mang điện tích dương. Hợp chất ion chỉ được tạo bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
? |
? |
|
? |
K+ |
O2- |
Lời giải:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
Ca2+ |
F- |
|
K2O |
K+ |
O2- |
Lời giải:
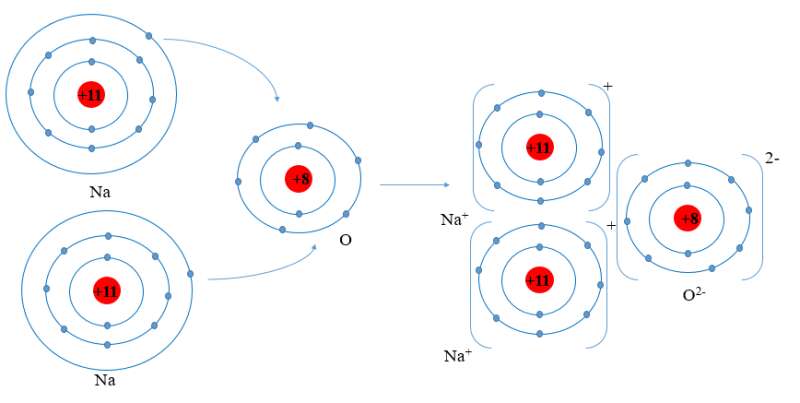
- Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
- Hai ion Na+ và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 55 Hóa học 10: Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào...
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết...
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?...
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?...
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.