Với giải Câu hỏi trang 66 SGK Hoá học10 Chân trời sáng tạo trong Bài 10: Liên kết cộng hoá trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Chân trời sáng tạo trang 66 Bài 10: Liên kết cộng hoá trị
Câu hỏi 20 trang 66 Hóa học 10: Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3.
Lời giải:
Các bước trong quá trình lắp ráp mô hình phân tử NH3:
Bước 1: Xác định hình học phân tử của chất cần lắp ráp.
Phân tử NH3 có dạng:
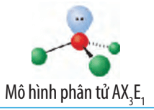
Công thức VESEPR của NH3 là AX3E1. Để giảm tối đa lực đẩy giữa 4 cặp electron hóa trị (gồm 3 cặp electron chung và 1 cặp electron riêng), 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất. Tuy nhiên cặp electron riêng đẩy mạnh hơn làm góc liên kết giảm, nên nhỏ hơn 109,5o
Bước 2: Xác định số lượng các loại liên kết và kiểu liên kết trong phân tử, qua đó xác định số lượng mỗi loại khối cầu và số thanh nối cần dùng.
Chọn 3 thanh nối biểu diễn 3 liên kết đơn N-H. Chọn 1 quả cầu biểu diễn nguyên tử N và 3 quả cầu (khác màu với N) biểu diễn 3 nguyên tử H.
Bước 3: Hoàn chỉnh mô hình phân tử

Câu hỏi 21 trang 66 Hóa học 10: Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?

Lời giải:
- Phân tử CH4 được tạo bởi 1 nguyên tử C và 4 nguyên tử H
- Phân tử CH3Cl được tạo bởi 1 nguyên tử C, 3 nguyên tử H và 1 nguyên tử Cl
⇒ Mô hình trên gồm 3 loại nguyên tử khác màu gồm: 1 nguyên tử C được biểu diễn bằng quả cầu màu đen, 3 nguyên tử H được biểu diễn bằng quả cầu màu trắng và 1 nguyên tử Cl được viểu diễn bằng quả cầu màu xanh.
⇒ Mô hình trên biểu diễn phân tử của CH3Cl
Lời giải:
Bước 1: Xác định hình học phân tử của chất cần lắp ráp.
Toàn bộ các nguyên tử nằm trên cùng một đường thẳng.
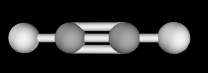
Bước 2: Xác định số lượng các loại liên kết và kiểu liên kết trong phân tử, qua đó xác định số lượng mỗi loại khối cầu và số thanh nối cần dùng.
Chuẩn bị 5 thanh nối tương ứng với 5 liên kết.
2 quả cầu màu xám biểu diễn nguyên tử C, hai quả cầu màu trắng biểu diễn nguyên tử H.
Bước 3: Hoàn chỉnh mô hình phân tử
Bài 1 trang 66 Hóa học 10: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Lời giải:
Đáp án đúng là: A
Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung ⇒ Mỗi nguyên tử I đều đạt 8 electron lớp ngoài cùng.
Nguyên tử I có 5 lớp electron.
⇒ Giống cấu hình khí hiếm Xe.
Bài 2 trang 66 Hóa học 10: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Lời giải:
- Sự tạo thành liên kết cộng hóa trị trong phân tử H2S:
+ Nguyên tử S có cấu hình electron là: 1s22s22p63s23p4. Cần 2 electron để đạt được cấu hình giống khí hiếm.
+ Nguyên tử H có cấu hình electron là: 1s1. Cần thêm 1 electron để đạt được cấu hình giống khí hiếm.
+ Khi hình thành phân tử, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
- Sự tạo thành liên kết cộng hóa trị trong phân tử PH3:
+ Nguyên tử P có cấu hình electron là: 1s22s22p63s23p3. Để đạt được cấu hình electron giống khí hiếm thì cần thêm 3 electron.
+ Nguyên tử H có cấu hình electron là: 1s1. Để đạt được cấu hình electron giống khí hiếm thì cần thêm 1 electron.
+ Khi hình thành phân tử, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử P để tạo thành 3 cặp electron dùng chung.
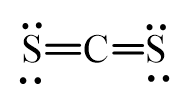
Bài 3 trang 66 Hóa học 10: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4.
Lời giải:
- Phân tử CS2: Mỗi nguyên tử S sẽ góp chung 2 electron mới nguyên tử C tạo thành 4 cặp electron dùng chung được biểu thị bằng 4 gạch nối.
 - Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
- Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
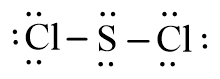 - Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron với nguyên tử C để tạo thành 4 cặp electron dùng chung.
- Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron với nguyên tử C để tạo thành 4 cặp electron dùng chung.
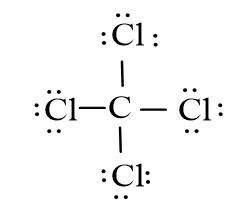
Lời giải:
+ O có cấu hình electron là 1s22s22p4 ⇒ O có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình bền vững của khí hiếm.
+ S có cấu hình electron là 1s22s22p63s23p4 ⇒ S có 6 elctron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình bền vững của khí hiếm.
+ Khi hình thành phân tử, một nguyên tử O góp chung 2 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
Nguyên tử O còn lại chưa được liên kết. Trong khi đó nguyên tử S vẫn còn 2 đôi electron chưa tham gia liên kết.
⇒ Nguyên tử S sẽ cho nguyên tử O chưa tham gia liên kết 1 cặp electron để dùng chung.
⇒ Công thức electron:
Công thức cấu tạo:
Lời giải:
- Cấu hình electron lớp ngoài cùng của nguyên tử chlorine được biểu diễn trên cái orbital như sau:
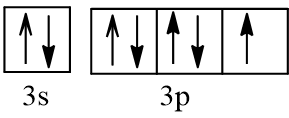
- Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ trục giữa hai AO p chứa electron độc thân của mỗi nguyên tử chlorine. Liên kết được tạo thành giữa hai nguyên tử chlorine là liên kết σ.
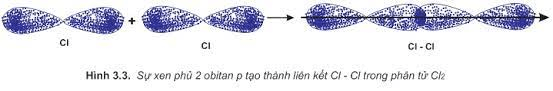
Lời giải:
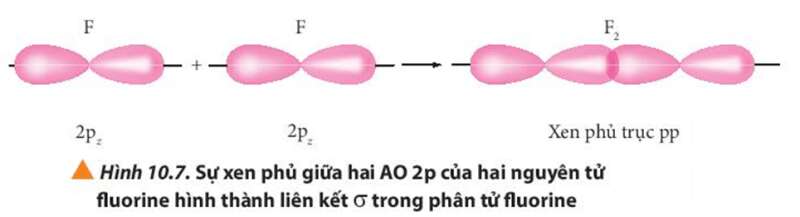
Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp. Chẳng hạn khi hình thành phân tử giữa hai nguyên tử, vị trí của các AO như sau:
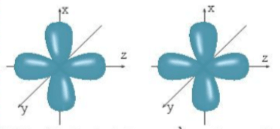
- Hai AO pz nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau ⇒ Chỉ tạo thành liên kết σ.
- Hai AO px hoặc hai AO py là song song nên chỉ có thể xen phủ bên với nhau ⇒ Tạo thành liên kết π.
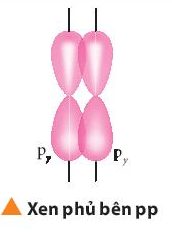
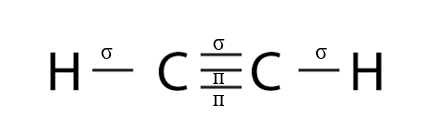
Bài 7 trang 66 Hóa học 10: Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Lời giải:
- Phân tử C2H2 gồm:
+ Hai liên kết đơn C-H. Hai liên kết này đều là liên kết σ.
+ Một liên kết ba C≡C gồm 1 liên kết σ và 2 liên kết π
Bài 8 trang 66 Hóa học 10: Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
|
Hydrogen halide |
Năng lượng liên kết (kJ/mol) |
|
HF |
565 |
|
HCl |
427 |
|
HBr |
363 |
|
HI |
295 |
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Lời giải:
HX nào có năng lượng liên kết càng lớn thì độ bền liên kết càng cao.
Sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF
⇒ Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 2 trang 59 Hóa học 10: Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2...
Câu hỏi 3 trang 60 Hóa học 10: Thế nào là liên kết đơn, liên kết đôi và liên kết ba?...
Luyện tập trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử Cl2...
Luyện tập trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3...
Luyện tập trang 61 Hóa học 10: Trình bày liên kết cho – nhận trong ion NH4+...
Luyện tập trang 63 Hóa học 10: Cho biết loại liên kết trong các phân tử MgCl2, CO2 và C2H4?...
Câu hỏi 12 trang 63 Hóa học 10: Mô tả sự hình thành liên kết σ...
Câu hỏi 13 trang 64 Hóa học 10: Mô tả sự hình thành liên kết π....
Câu hỏi 16 trang 64 Hóa học 10: Sự xen phủ có sự tham gia của orbital nào luôn là xen phủ trục?...
Câu hỏi 19 trang 65 Hóa học 10: Theo em vì sao năng lượng liên kết luôn có giá trị dương?...
Câu hỏi 20 trang 66 Hóa học 10: Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3....
Câu hỏi 21 trang 66 Hóa học 10: Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?...
óa học 10: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4...
Bài 7 trang 66 Hóa học 10: Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2)...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.