Với giải Câu hỏi trang 90 SGK Hoá học10 Kết nối tri thức Bài 18: Ôn tập chương V giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Kết nối tri thức trang 90 Bài 18: Ôn tập chương V
Câu 4 trang 90 Hóa học 10: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Biến thiên enthalpy của phản ứng C3H8(g) → CH4(g) + C2H4(g) có giá trị là
A. +103 kJ. B. – 103 kJ.
C. +80 kJ. D. – 80 kJ.
Lời giải:
Đáp án đúng là: C
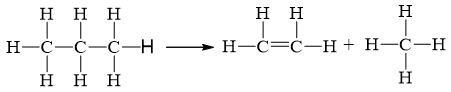
2.Eb(C – C) + 8.Eb(C – H) = 2.346 + 8.418 = 4036 kJ
1.Eb(C = C) + 8.Eb(C – H) = 1.612 + 8.418 = 3956 kJ
⇒ = 4036 – 3956 = 80 kJ
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Hãy tính nhiệt tạo thành chuẩn của khí methane.
Lời giải:
⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [ + 0.2]
⇒ = – 74,8 kJ/mol
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l) = – 1 365 kJ
C57H110O6(s) + O2(g) → 57 CO2(g) + 55H2O(l) = – 35 807 kJ
Lời giải:
Đốt cháy 46 gam (1mol) C2H5OH tỏa ra lượng nhiệt là 1 365 kJ
⇒ Đốt cháy 1000 gam (1 kg) C2H5OH tỏa ra lượng nhiệt là kJ.
Đốt cháy 890 gam (1mol) C57H110O6 tỏa ra lượng nhiệt là 35 807 kJ.
⇒ Đốt cháy 1000 gam (1kg) C57H110O6 tỏa ra lượng nhiệt là kJ.
So sánh:
Nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg tristearin có trong mỡ lợn > khi đốt cháy hoàn toàn 1 kg cồn.
Câu 7 trang 90 Hóa học 10: Biết CH3COCH3 có công thức cấu tạo:
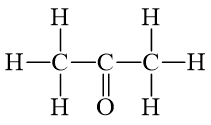 Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy xác định biến thiên enthalpy của phản ứng đốt cháy acetone (CH3COCH3):
Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy xác định biến thiên enthalpy của phản ứng đốt cháy acetone (CH3COCH3):
CH3COCH3(g) + 4O2(g) → 3CO2(g) + 3H2O(g)
Lời giải:
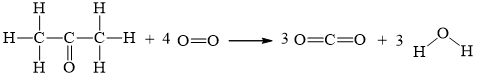 2.Eb(C – C) + 6.Eb(C – H) + 1.Eb(C = O) + 4.Eb(O = O)
2.Eb(C – C) + 6.Eb(C – H) + 1.Eb(C = O) + 4.Eb(O = O)
= 2.346 + 6.418 + 1.732 + 4. 494 = 5908 kJ
6.Eb(C = O) + 6.Eb(O – H) = 6.732 + 6.459 = 7146 kJ
⇒ = 5908 – 7146 = - 1238 kJ
Câu 8 trang 90 Hóa học 10: Một bình gas (khí hoá lỏng) chứa hỗn hợp propane và butane với tỉ lệ số mol 1:2. Xác định nhiệt lượng toả ra khi đốt cháy hoàn toàn 12 kg khí gas trên ở điều kiện chuẩn.
Cho biết các phản ứng:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(1) = –2 220 kJ
C4H10(g) + O2(g) → 4CO2(g) + 5H2O (1) = –2 874 kJ
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10 000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?
Lời giải:
Gọi x là số mol của propane trong bình gas.
⇒ 2x là số mol của butane trong bình gas.
Theo bài, ta có: 44x + 58.2x = 12.1000 ⇒ x = 75
Tổng nhiệt lượng tỏa ra khi đốt cháy hoàn toàn một bình gas là:
75.2220 + 2.75.2874 = 597600 kJ
Số ngày mà hộ gia đình sử dụng hết bình gas là
ngày ≈ 48 ngày
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Câu 1 trang 89 Hóa học 10: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P)...
Câu 2 trang 89 Hóa học 10: Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn...
Câu 4 trang 90 Hóa học 10: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn...
Câu 7 trang 90 Hóa học 10: Biết CH3COCH3 có công thức cấu tạo...
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.