Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Ôn tập chương 5 Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Ôn tập chương 5 Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Hệ thống kiến thức cần nắm vững
1. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
+ Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Ví dụ: Phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, … đều là các phản ứng tỏa nhiệt.
+ Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Ví dụ: Các phản ứng trong lò nung vôi, nung clinker xi măng, … là các phản ứng thu nhiệt.
2. Biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là ∆rH là nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định.
- Phương trình hóa học kèm theo trạng thái của các chất và giá trị ∆rH gọi là phương trình nhiệt hóa học.
- Biến thiên enthalpy chuẩn của một phản ứng hóa học, kí hiệu là ![]() , chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn.
, chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn.
- Chú ý: Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K (25oC).
4. Ý nghĩa của biến thiên enthalpy
- Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
∆rH > 0: phản ứng thu nhiệt.
∆rH < 0: phản ứng tỏa nhiệt.
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
5. Tính biến thiên enthapyl của phản ứng theo nhiệt tạo thành
- Nhiệt tạo thành của một chất (∆fH) là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
- Nhiệt tạo thành chuẩn ( ![]() ) là nhiệt tạo thành ở điều kiện chuẩn.
) là nhiệt tạo thành ở điều kiện chuẩn.
- Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành:
Ở điều kiện chuẩn: ![]()
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
6. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
- Ở điều kiện chuẩn:
![]()
Bài tập
Câu 1. Phát biểu nào sau đây sai?
A. Phản ứng tỏa nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ chất phản ứng ra môi trường;
B. Phản ứng thu nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng;
C. Phản ứng phân hủy là phản ứng thu nhiệt;
D. Phản ứng phân hủy là phản ứng tỏa nhiệt.
Đáp án: D
Phản ứng phân hủy là phản ứng thu nhiệt.
Câu 2. Nhiệt tạo thành chuẩn của khí oxygen trong phản ứng hóa học là?
A. 0 kJ/mol;
B. 1 kJ/mol;
C. 273 kJ/mol;
D. 298 kJ/mol.
Đáp án: A
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
Câu 3. Biến thiên enthalpy của các phản ứng phụ thuộc vào yếu tố nào?
A. Điều kiện xảy ra phản ứng;
B. Trạng thái vật lý của các chất;
C. Số lượng chất tham gia;
D. Cả A và B đều đúng.
Đáp án: D
Biến thiên enthalpy của các phản ứng phụ thuộc vào điều kiện xảy ra phản ứng (như nhiệt độ, áp suất) và trạng thái vật lý của các chất (rắn, lỏng, khí). Để so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định chúng ở cùng một điều kiện.
Câu 4. Phản ứng sau thuộc loại phản ứng nào?
![]()
A. Phản ứng tỏa nhiệt;
B. Phản ứng thu nhiệt;
C. Vừa thu nhiệt, vừa tỏa nhiệt;
D. Không thuộc loại nào.
Đáp án: A
![]() < 0 phản ứng tỏa nhiệt.
< 0 phản ứng tỏa nhiệt.
Câu 5. Biến thiên enthalpy chuẩn được xác định ở nhiệt độ nào?
A. 0oC;
B. 25oC;
C. 40oC;
D. 100oC.
Đáp án: B
Biến thiên enthapy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ là 25oC (298K).
Câu 6. Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo nhiệt tạo thành là?
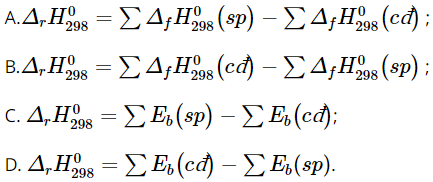
Đáp án: A
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo nhiệt tạo thành là:
![]()
Câu 7. Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là?
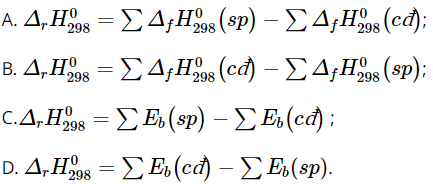
Đáp án: D
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là:
![]()
Câu 8. Đơn vị của biến thiên enthalpy của phản ứng là?
A. kJ;
B. kJ/mol;
C. mol/kJ;
D. g.
Đáp án: A
Đơn vị của biến thiên enthalpy của phản ứng là kJ.
Câu 9. Để xác định biến thiên enthalpy bằng thực nghiệm người ta có thể dùng dụng cụ nào?
A. Nhiệt kế;
B. Nhiệt lượng kế;
C. Vôn kế;
D. Ampe kế.
Đáp án: B
Biến thiên enthalpy của phản ứng có thể xác định bằng nhiệt lượng kế. Dựa vào kết quả khi xác định sự thay đổi nhiệt độ nước sẽ tính được nhiệt lượng đã cho đi (hoặc nhận vào), từ đó xác định được biến thiên enthalpy của phản ứng.
Câu 10. Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
![]()
Biết nhiệt tạo thành của CaCO3(s) là -1206,9 kJ/mol, của CaO(s) là -635,1 kJ/mol của CO2(g) là - 393,5 kJ/mol.
A. - 178,9 kJ;
B. - 1028,6 kJ;
C. 178,3 kJ;
D. - 1206 kJ.
Đáp án: C
Tổng nhiệt tạo thành các chất đầu là:
![]()
Tổng nhiệt tạo thành các chất sản phẩm là:
![]()
Biến thiên enthalpy của phản ứng là:
![]() =−1028,6−(−1206,9)=178,3(kJ)
=−1028,6−(−1206,9)=178,3(kJ)
Câu 11. Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
SO2(g) + ![]() O2(g) → SO3(l)
O2(g) → SO3(l) ![]() = −144,2kJ
= −144,2kJ
Biết nhiệt tạo thành chuẩn của SO3: ![]() (SO3(l)) = −441,0kJ/mol
(SO3(l)) = −441,0kJ/mol
Nhiệt tạo thành chuẩn của SO2 là?
A. - 441,0 kJ/mol;
B. -144,2 kJ/mol;
C. - 296,8 kJ/mol;
D. 0 kJ/mol.
Đáp án: C
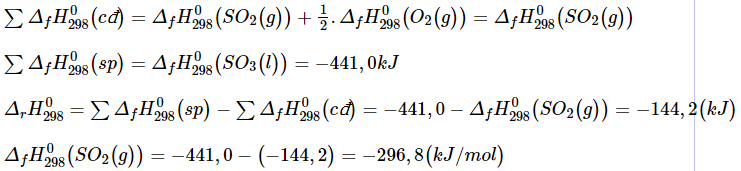
Câu 12. Sự thay đổi năng lượng trong một quá trình hóa học phụ thuộc vào yếu tố nào?
A. Trạng thái của các chất ban đầu và sản phẩm;
B. Cách phản ứng xảy ra;
C. Các sản phẩm trung gian;
D. Chất xúc tác.
Đáp án: A
Năm 1840, nhà hóa học người Thụy Sĩ là G. Hess đã đề xuất một định luật về sau mang tên ông, trong đó nói rằng những sự thay đổi năng lượng trong một quá trình hóa học chỉ phụ thuộc vào trạng thái của các chất ban đầu và sản phẩm mà không phụ thuộc vào cách phản ứng xảy ra và các sản phẩm trung gian.
Câu 13. Tính biến thiên enthalpy chuẩn của phản ứng:
C4H10(g) → C2H4(g) + C2H6(g)
Biết Eb (H-H) = 436 kJ/mol, Eb (C-H) = 418 kJ/mol, Eb (C-C) = 346 kJ/mol, Eb (C=C) = 612 kJ/mol.
A. - 80 kJ;
B. - 734 kJ;
C. - 915 kJ;
D. 80 kJ.
Đáp án: D
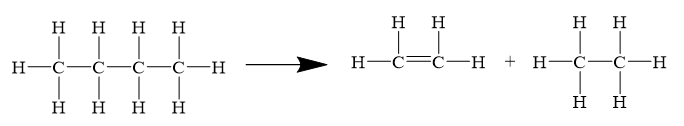
![]() = 10Eb(C−H) + 3Eb(C−C) − Eb(C=C) − 4Eb(C−H) − Eb(C−C) − 6Eb(C−H)
= 10Eb(C−H) + 3Eb(C−C) − Eb(C=C) − 4Eb(C−H) − Eb(C−C) − 6Eb(C−H)
![]() = 10.418 + 3.346 – 612 − 4.418 – 346 − 6.418 = 80(kJ)
= 10.418 + 3.346 – 612 − 4.418 – 346 − 6.418 = 80(kJ)
Câu 14. Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
Biết nhiệt tạo thành của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là - 177,9 kJ/mol, - 825,5 kJ/mol và - 296,8 kJ/mol.
Phát biểu nào sau đây là sai?
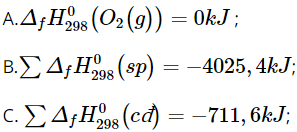
D. Đây là phản ứng thu nhiệt.
Đáp án: D
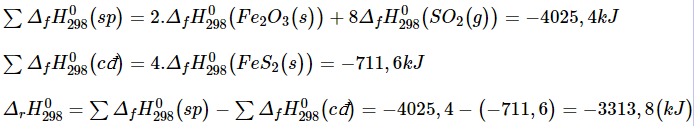
Do ![]() < 0 nên đây là phản ứng tỏa nhiệt.
< 0 nên đây là phản ứng tỏa nhiệt.
Câu 15. Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
C2H4(g) + H2(g) → C2H6(g)
Biết Eb (H-H) = 436 kJ/mol, Eb (C-H) = 418 kJ/mol, Eb (C-C) = 346 kJ/mol, Eb (C=C) = 612 kJ/mol.
Phát biểu nào sau đây là sai?
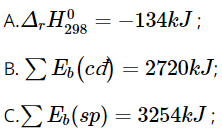
D. Đây là phản ứng tỏa nhiệt.
Đáp án: C
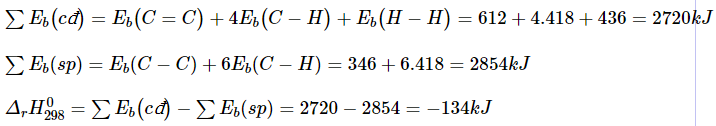
Do ![]() < 0 nên đây là phản ứng tỏa nhiệt.
< 0 nên đây là phản ứng tỏa nhiệt.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.