Toptailieu.vn xin giới thiệu 34 câu trắc nghiệm Nhóm Halogen Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
34 câu trắc nghiệm Nhóm Halogen Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Nhóm halogen trong bảng tuần hoàn các nguyên tố
- Gồm có các nguyên tố 9F 7Cl 35Br 53I 85At. Phân tử dạng X2 như F2 khí màu lục nhạt, Cl2 khí màu vàng lục, Br2 lỏng màu nâu đỏ, I2 tinh thể tím.
II. Cấu hình electron nguyên tử và cấu tạo phân tử của các nguyên tố trong nhóm halogen
- Cấu hình electron lớp ngoài cùng của nguyên tử các halogen là ns2np5
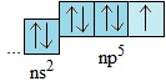
- Dễ nhận thêm một electron để đạt cấu hình bền vững của khí hiếm
X + 1e → X- (X: F, Cl, Br, I)
- Ở trạng thái cơ bản, nguyên tử các halogen đều có một electron độc thân.
- Lớp electron ngoài cùng của nguyên tử flo là lớp thứ hai nên không có phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống, khi được kích thích 1, 2 hoặc 3 electron có thể chuyển đến những obitan d còn trống:
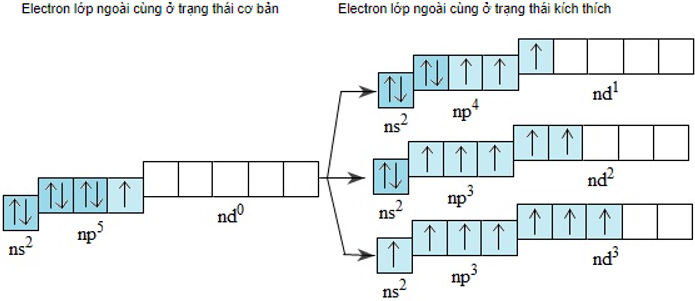
Do đó ở các trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3, 5 hoặc 7 electron độc thân.
1. Tính chất vật lý
- Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần từ F đến I.
- Nguyên tử halogen có 7e lớp ngoài cùng ns2np5, bán kính nguyên tử nhỏ, có độ âm điện lớn ⇒ dễ nhận e, halogen có tính oxi hóa mạnh và là phi kim điển hình.
Ion halogenua X- có mức oxi hóa thấp nhất nên thể hiện tính khử.
| I2 Br2 Cl2 F2 | Tính oxi hóa tăng dần |
| 2I- 2Br- 2Cl- 2F- | Tính khử giảm dần |
- Lí tính:
| Halogen | F2 | Cl2 | Br2 | I2 |
| Trạng thái | Khí | Khí | Lỏng | Rắn |
| Màu sắc | Xanh nhạt | Vàng lục | Đỏ nâu | Tím than |
- Giữa các phân tử X2 chỉ có lực hút Van der Waals yếu nên các halogen hoặc ở trạng thái khí (F2, Cl2) hoặc ở trạng thái lỏng (Br2) dễ bay hơi, cũng có thể ở trạng thái rắn (I2) dễ thăng hoa.
- Tính tan: Flo phân hủy nước rất mạnh nên không tan trong nước.
Các halogen khác tan tương đối ít trong nước và tan nhiều trong dung môi hữu cơ.
2. Tính chất hóa học
- Cấu hình e lớp ngoài cùng tương tự nhau nên các halogen có nhiều điểm giống nhau về tính chất hóa học:
+ Có 7 e lớp ngoài cùng nên có xu hướng nhận thêm 1 e tạo thành ion âm X-.
+ Là phi kim điển hình, có tính oxi hóa mạnh.
- Tính oxi hóa của halogen:
Nhóm halogen với 7 điên tử ở lớp ngoài cùng và độ âm điện lớn, nguyên tử halogen X dễ dàng lấy 1 điện tử tạo ra X- có cấu hình khí trơ bền vững.
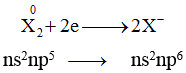
Do đó tính chất quan trọng nhất của nhóm halogen là tính oxi hóa, tính này giảm dần từ F2 (chất oxi hóa mạnh nhất) đến I2 (chất oxi hóa trung bình).
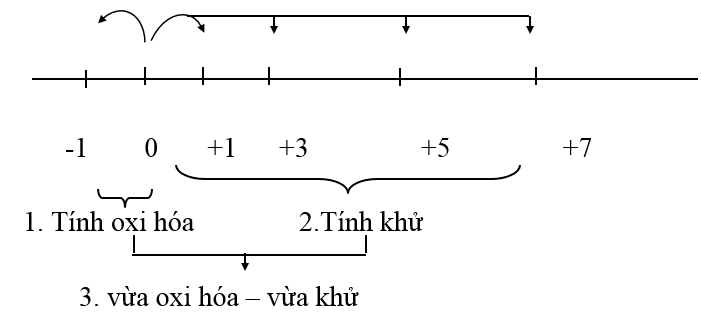
Các bậc oxi hóa đặc trưng của các halogen là: -1, 0, +1, +3, +5, +7 (trừ F luôn có số oxi hóa -1).
Ở dạng đơn chất, các halogen tồn tại dưới dạng phân tử X2. Có bậc oxi hóa trung gian là 0 là bậc oxi hóa trung gian. Nên nó vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
Bài tập
Câu 1: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là:
A. ns2np4. B. ns2p5. C. ns2np3. D. ns2np6.
Đáp án: B
Câu 2: Liên kết trong các phân tử đơn chất halogen là gì?
A. công hóa trị không cực.
B. cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho nhận.
Đáp án: A
Câu 3: Chất nào có tính khử mạnh nhất?
A. HI. B. HF. C. HBr. D. HCl.
Đáp án: A
Câu 4: Trong phản ứng clo với nước, clo là chất:
A. oxi hóa.
B. khử.
C. vừa oxi hóa, vừa khử.
D. không oxi hóa, khử.
Đáp án: C
Câu 5: Cho dãy axit: HF, HCl, HBr, HI. Theo chiều từ trái sang phải tính chất axit biến đổi như sau:
A. giảm.
B. tăng.
C. vừa tăng, vừa giảm.
D. Không tăng, không giảm.
Đáp án: B
Câu 6: Hãy lựa chọn phương pháp điều chế khí hidroclorua trong phòng thí nghiệm:
A. Thủy phân AlCl3.
B. Tổng hợp từ H2 và Cl2.
C. clo tác dụng với H2O.
D. NaCl tinh thể và H2SO4 đặc.
Đáp án: D
Câu 7: Axit không thể đựng trong bình thủy tinh là:
A. HNO3 B. HF. C. H2SO4. D. HCl.
Đáp án: B
Câu 8: Dung dịch AgNO3 không phản ứng với dung dịch nào sau đây?
A. NaCl B. NaBr. C. NaI. D. NaF.
Đáp án: D
Câu 9: Đặc điểm nào không phải là đặc điểm chung của các halogen?
A. Đều là chất khí ở điều kiện thường.
B. Đều có tính oxi hóa mạnh.
C. Tác dụng với hầu hết các kim loại và phi kim.
D. Khả năng t/d với nước giảm dần từ F2 đến I2.
Đáp án: A
Câu 10. Trong phương trình MnO2 + HCl → MnCl2 + Cl2 + H2O thì hệ số cân bằng của HCl là bao nhiêu?
A. 1. B. 2 . C. 3. D. 4.
Đáp án: D
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Câu 11: Trong các kim loại sau đây, kim loại nào khi tác dụng với clo và axit clohidric cho cùng một loại muối?
A. Zn. B. Fe. C. Cu. D. Ag
Đáp án: A
Câu 12: Dãy các chất nào sau đây đều tác dụng với axit clohidric?
A. Fe2O3, KMnO4, Cu, Fe, AgNO3.
B. Fe2O3, KMnO4¸Fe,CuO, AgNO3.
C. Fe, CuO, H2SO4, Ag, Mg(OH) 2.
D.KMnO4,Cu,Fe,H2SO4, Mg(OH) 2.
Đáp án: B
Câu 13: Phản ứng nào chứng tỏ HCl là chất khử?
A. HCl + NaOH → NaCl + H2O.
B. 2HCl + Mg MgCl2+ H2 .
C. MnO2+ 4 HCl → MnCl2+ Cl2+ 2H2O.
D. NH3+ HCl → NH4Cl.
Đáp án: C
Câu 14: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
A. HF, HCl, HBr, HI.
B. HF, HCl, HBr và một phần HI
C. HF, HCl, HBr.
D. HF, HCl .
Đáp án: D
2NaF + H2SO4 → Na2SO4 + 2HF
2NaCl + H2SO4 → Na2SO4 + 2HCl
2NaBr + 2H2SO4 → Na2SO4 + Br2 + SO2 + 2H2O
8NaI + 5H2SO4 → 4Na2SO4 + 4I2 + H2S + 4H2O
Câu 15: Brom bị lẫn tạp chất là Clo. Cách nào sau đây có thể thu được brom tinh khiết?
A. Dẫn hỗn hợp khí đi qua dung dịch NaOH
B. Dẫn hỗn hợp khí đi qua dung dịch nước
C. Dẫn hỗn hợp khí đi qua dung dịch NaBr
D. Dẫn hỗn hợp khí đi qua dung dịch NaI.
Đáp án: C
Câu 16: Hoà tan V lít khí HCl (đktc) vào 185,4 gam dung dịch HCl 10% thu được dung dịch HCl 16,57%. Giá trị của V là
A. 4,48. B. 8,96. C. 2,24. D. 6,72.
Đáp án: B
Sử dụng PP đường chéo coi nồng độ HCl dạng khí là 100% tính được mHCl= 14,6g từ đó suy ra V
Câu 17: Phương pháp để điều chế khí F2 trong công nghiệp là:
A. oxi hóa muối florua.
B. dùng halogen khác đẩy flo ra khỏi muối.
C. điện phân hỗn hợp KF và HF ở thể lỏng.
D. không có phương pháp nào.
Đáp án: C
Câu 18: Số oxi hóa của brom trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là:
A. -1, +1, +1, +3.
B. -1, +1, +2, +3.
C. -1, +1, +5, +3.
D. +1, +1, +5, +3.
Đáp án: C
Câu 19: Cho 16,15 gam dung dịch A gồm hai muối NaX, NaY (X, Y là hai halogen liên tiếp) tác dụng với dung dịch AgNO3 dư thu được 33,15 gam kết tủa trắng. X và Y lần lượt là:
A. F và Cl B. Cl và Br C. Br và I D. Cl và I
Đáp án: B
Áp dụng PP tăng giảm khối lượng ⇒ nA = (33,15-16,15)/(108-23)= 0,2 mol ⇒ MA = 80,75 ⇒ (X,Y) = 57,75 ⇒ X, Y là Cl và Br.
Câu 20. Cho 26,1 g MnO2 tác dụng với dung dịch HCl dư thu được 6,048 lít Cl2 (ở đktc).Tính hiệu suất của phản ứng.
A. 80% B. 90% C. 100% D.95%
Đáp án: B
MnO2 + 4HCl → MnCl2 + Cl2 ↑ + 2H2 O
nMnO2= 26,1/87 = 0,3 mol . Theo pt: nCl2 = nMnO2 = 0,3 mol
Theo bài nCl2 = 6,048/22,4 = 0,27 mol ⇒ H = 0,27/0,3 = 90%.
Câu 21: Hòa tan 16 g oxit của kim loại X hóa trị III cần dùng 109,5 g dung dịch HCl 20%. Xác định tên X.
A. Al B. Fe C. Cr D.Mg
Đáp án: B
PTHH: X2 O3 + 6HCl → 2XCl3 + 3H2 O
nHCl = 109,5/36,6 .20% = 0,6 mol ⇒ nX2O3 = 0,6/6= 0,1 mol
MX2O3 = 16/0,1 = 160 ⇒ MX = 56 (Fe).
Câu 22: Hòa tan 27,6g muối R2 CO3 vào một lượng dung dịch HCl 2M thu được 29,8 g muối. Xác định tên R và thể tích dung dịch HCl đã dùng.
A. K; 2M B. Na; 2M C. K; 0,2M D. Na; 0,2 M
Đáp án: C
R2 CO3 + 2HCl → RCl2 + CO2 + H2 O
Áp dụng PP tăng giảm khối lượng ⇒ nR2CO3 = (29,8 -27,6) /(71-60) = 0,2 mol
⇒ MR2CO3 = 27,6/0,2 = 138 ⇒ MR = 39 (K)
Theo Pt: nHCl = 2. NR2CO3 = 0,4 mol ⇒ CM -(HCl) = 0,4/2 =0,2 M
Câu 23: Hoà tan hoàn toàn 25,12 gam hỗn hợp Mg, Al, Fe trong dung dịch HCl dư thu được 13,44 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 67,72. B. 46,42. C. 68,92 D. 47,02.
Đáp án: A
nH2 = 0,6 mol ⇒ nHCl = 0,6 .2 =1,2 mol
M Muối = mKL + mCl- = 25,12 + 1,2 . 35,5 = 67,72g
Câu 24. Phản ứng nào sau đây được dùng để điều chế khí hidro clorua trong phòng thí nghiệm?
A. H2 + Cl2 → 2HCl
B. Cl2 + H2O ↔ HCl + HClO
C. NaCl(rắn) + H2SO4(đặc) → NaHSO4 + HCl
D. Cl2 + SO2 + 2H2O → 2HCl + H2SO4
Đáp án: C
Câu 25. Sục khí clo qua dung dịch K2CO3 thấy có khí thoát ra bì đã xảy ra phản ứng:
A. Cl2 + H2O ↔ HCl + HClO ; 2HCl + K2CO3 → 2KCl + CO2 + H2O
B. Cl2 + K2CO3 → 2KCl + CO2 + H2O
C. 2HClO + K2CO3 → 2KCl + CO2 + H2O + O2
D. Cl2 + H2O ↔ HCl + HClO; 2HClO + K2CO3 → 2KClO + CO2 + H2O
Đáp án: A
Câu 26. Phương trình nào sau đây được dùng để điều chế hidro bromua trong thực tế?
A. H2SO4 đặc + KBr → KHSO4 + HBr
B. HCl + KBr → KCl + HBr
C. PBr3 + 3H2O → H3PO3 + 3HBr
D. HNO3 + KBr → KNO3 + HBr
Đáp án: C
Câu 27. Những dãy chất nào trong các dãy sau được dùng để điều chế nước Ja – ven trong phòng thí nghiệm?
A. NaCl, MnO2, H2SO4 đặc
B. NaCl, MnO2, NaOH, H2SO4 đặc
C. H2O, KCl
D. Ca(OH)2, NaCl, Cl2
Đáp án: B
4NaCl + 4H2SO4đ + MnO2 → MnCl2 + 4NaHSO4 + Cl2↑ + 2H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 28. Cho một halogen tác dụng với nhôm thì thu được muối trong đó khối lượng muối gấp 9,89 lần khối lượng Al đã phản ứng. Vậy halogen là:
A. Flo B. Clo C. Brom D. Iot
Đáp án: C
2Al + 3X2 → 2AlX3
Theo đề ra: (2 ×(27+3X))/2.27 = 9,89
→ X = 80 → X là Br
Câu 29. Có 185,4 gam dung dịch axit clohidric 10%. Hòa tan thêm Vlít khí HCl ở điều kiện chuẩn để thu được dung dịch axit clohidric 16,57%. Vậy V (lít) có giá trị là:
A. 5,6 B. 6,72 C. 8,96 D. 11,2
Đáp án: C
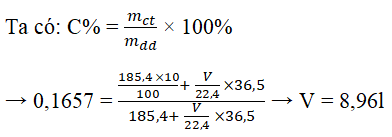
Câu 30. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng với brom thu được 40,05 gam muối. M là:
A. Mg B. Al C. Fe D. Cu
Đáp án: B
Phương trình phản ứng.
M + n/2Br2 → MBrn
M M + 80n
4,05 40,05
→ M = 9n → M chỉ có thể là Al
Câu 31. Cho 17,4 gam MnO2 tác dụng hết với HCl lấy dư. Toàn bộ khí clo sinh ra được hấp thụ hết vào 148,5 gam dung dịch NaOH 20% (ở nhiệt độ thường) tạo ra dung dịch A. Vậy dung dịch A có các chất và nồng độ % tương ứng như sau:
A. NaCl 10% ; NaClO 5%
B. NaCl 7,31%; NaClO 6,81%, NaOH 6%
C. NaCl 7,19%; NaClO 9,16%, NaOH 8,42%
D. NaCl 7,31%; NaClO 9,31%, HCl 5%
Đáp án: C
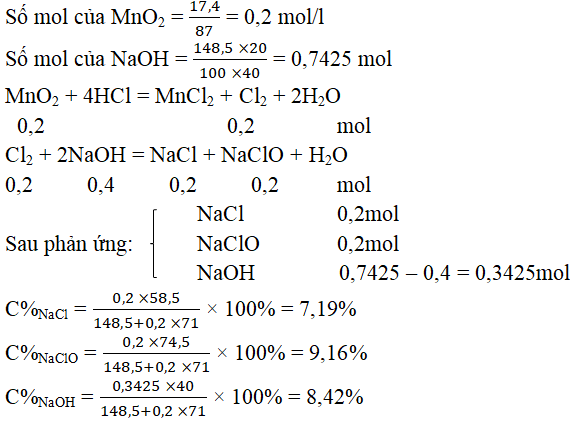
Câu 32. Cho 19,05 gam hỗn hợp KF và KCl tác dụng hết với dung dịch H2SO4 đặc thu được 6,72 lít khí (đktc). Vậy % theo khối lượng của KF và KCl là:
A. 60,20% và 39,80%
B. 60,89% và 39,11%
C. 39,11% và 60,89%
D. 70% và 30%
Đáp án: B
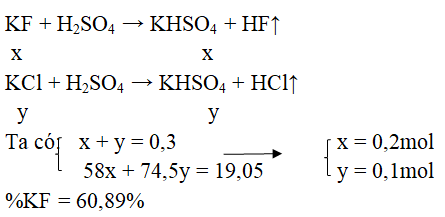
Câu 33. Dẫn từ từ khí clo qua bình đựng KI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là:
A. Dung dịch hiện màu vàng
B. Dung dịch hiện màu xanh
C. Dung dịch có màu trắng
D. Có kết tủa màu vàng nhạt
Đáp án: B
Câu 34. Cho 2,24 lít khí HCl ở đkc vào 100ml dung dịch NaOH 1,2M. Dung dịch sau phản ứng có môi trường:
A. Axit B. Bazơ C. Trung tính D. Lưỡng tính
Đáp án: B
Số mol các chất
nHCl = 0,1 mol; nNaOH = 0,12mol
NaOH + HCl → NaCl + H2O
nNaOHdư → môi trường bazơ → quỳ tím chuyển màu xanh
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.