Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Ôn tập chương 7 Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Ôn tập chương 7 Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
- Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen, gồm 6 nguyên tố: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts). Bốn nguyên tố F, Cl, Br, I tồn tại trong tự nhiên; còn At và Ts là các nguyên tố phóng xạ.
1. Nguyên tử halogen
- Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất:
ns2np5 + 1e → ns2np6
- Số oxi hóa đặc trưng của các halogen trong hợp chất là -1.
- Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có số oxi hóa dương: +1; +3; +5; +7 (trừ fluorine có độ âm điện lớn nhất nên fluorine luôn có số oxi hóa bằng -1 trong mọi hợp chất).
2. Đơn chất halogen
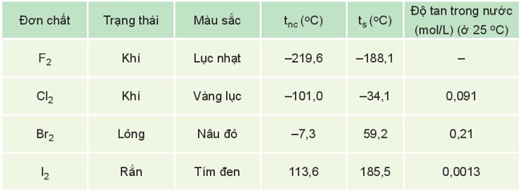
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
- Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
+ Cho quặng pyrolusite (MnO2) tác dụng với hydrochloric đặc:
MnO2 + 4HCl đặc ![]() MnCl2 + Cl2 + 2H2O
MnCl2 + Cl2 + 2H2O
+ Có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- Trong công nghiệp, chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực:
2NaCl + 2H2O ![]() 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
3. Hydrogen halide
- Phân tử hydrogen halide (HX) gồm một liên kết cộng hóa trị. Các phân tử HX là phân tử phân cực.
![]()
Hoặc H – X
- Một số đặc điểm của hydrogen halide được thể hiện trong bảng sau:
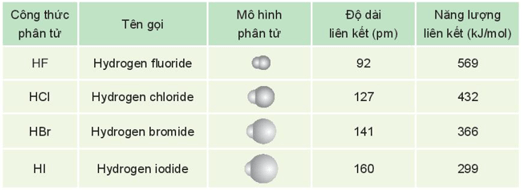
- Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng.
4. Muối halide
- Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan, ví dụ như silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chloride, lead bromide.
- Phân biệt các ion F-; Cl-; Br-; I- trong dung dịch: dùng dung dịch silver nitrate
+ Khi ion là F- thì không thấy sự biến đổi, do không có phản ứng hóa học xảy ra.
+ Khi ion là Cl- thì xuất hiện kết tủa trắng silver chloride (AgCl).
+ Khi ion là Br- thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi ion là I- thì xuất hiện kết tủa màu vàng silver iodide (AgI).
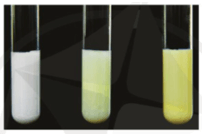
- Phương trình hóa học minh họa:
NaCl + AgNO3 → NaNO3 + AgCl ↓
NaBr + AgNO3 → NaNO3 + AgBr ↓
NaI + AgNO3 → NaNO3 + AgI ↓
- Tính khử của các ion halide tăng dần theo thứ tự: Cl- < Br- < I-
- Ví dụ:
+ Sodium bromide khử được sulfuric acid đặc thành sulfur đioxide:
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O
+ Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide:
8NaI + 9H2SO4 → 8NaHSO4 + 4I2 + H2S + 4H2O
+ Trong điều kiện như trên NaCl, chỉ xảy ra phản ứng trao đổi tạo thành hydrogen chloride.
Bài tập
Câu 1. Trong các halogen, halogen nào ở trạng thái lỏng trong điều kiện thường?
A. Chlorine;
B. Bromine;
C. Iodine;
D. Fluorine.
Đáp án: B
Trong điều kiện thường, fluorine và chlorine ở trạng thái khí, bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Câu 2. Tính oxi hoá của các halogen tăng dần theo thứ tự nào sau đây?
A. Cl2, F2, Br2, I2;
B. F2, Cl2, Br2, I2;
C. I2, Br2, Cl2, F2;
D. I2, Cl2, Br2, F2.
Đáp án: C
Tính oxi hoá của các halogen tăng dần từ I2 đến F2.
Câu 3. Một nguyên tố halogen có lớp electron ngoài cùng là 3s23px. Nguyên tố đó là:
A. F (Z = 9);
B. Cl (Z = 17);
C. Br (Z = 35);
D. Chưa biết.
Đáp án: B
Một nguyên tố halogen có lớp electron ngoài cùng là 3s23px
Nguyên tố halogen thuộc chu kì 3
Nguyên tố đó là Cl (Z =17).
Câu 4. Phản ứng của H2 và Cl2 xảy ra trong điều kiện nào?
A. Ở nhiệt độ phòng và trong bóng tối;
B. Ánh sáng hoặc to;
C. 200oC, xúc tác Pt;
D. 300oC, xúc tác Pt.
Đáp án: B
Phản ứng của H2 và F2 xảy ra ngay ở nhiệt độ phòng và trong bóng tối.
Phản ứng của H2 và Cl2 xảy ra khi có ánh sáng hoặc to.
Phản ứng của H2 và Br2 xảy ra ở khoảng 200oC, xúc tác Pt.
Phản ứng của H2 và I2 xảy ra ở khoảng 300oC, xúc tác Pt.
Câu 5. Acid có tính khử mạnh nhất là?
A. HF;
B. HCl;
C. HBr;
D. HI.
Đáp án: D
Thứ tự sắp xếp tính khử giảm dần là: HI > HBr > HCl > HF.
Câu 6. Phát biểu nào sau đây không đúng?
A. Trong tự nhiên các halogen tồn tại ở dạng đơn chất;
B. Độ âm điện giảm dần từ F, Cl, Br, I;
C. Muối AgF tan, còn AgCl, AgBr, AgI, không tan trong H2O;
D. Các hydrogen halide đều là chất khí, dung dịch của chúng đều có tính acid.
Đáp án: A
Trong tự nhiên các halogen chỉ tồn tại ở dạng hợp chất.
Câu 7. Trong các chất sau, chất thường dùng để khử trùng nước sinh hoạt là
A. N2
B. O2
C. CO2
D. Cl2
Đáp án: D
Chất thường dùng để khử trùng nước sinh hoạt là Cl2.
Câu 8. Thực hiện các thí nghiệm sau:
(a) Cho dung dịch NaCl vào dung dịch KOH.
(b) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(c) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(d) Cho Cu(OH)2 vào dung dịch NaNO3.
(e) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Số các thí nghiệm đều sinh ra NaOH là:
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án: C
Các thí nghiệm đều điều chế được NaOH là: (b), (c), (e).
(b) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
(c) ![]()
(e) Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
Câu 9. Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2;
B. 4;
C. 1;
D. 3.
Đáp án: A
Phản ứng trong đó HCl thể hiện tính khử là: (a), (c)
Do số oxi hóa của Cl từ -1 lên 0.
Câu 10. Dung dịch HCl tác dụng với các chất trong dãy nào sau đây?
A. MnO2; Fe3O4; NaHS; FeS;
B. KMnO4; Na2O; CH3COOH; CuS;
C. Fe; Ag2O; KHCO3; S;
D. PbO2; CuO; SO2; Na2S.
Đáp án: A
Loại B vì CH3COOH, CuS không phản ứng;
Loại C vì S không phản ứng;
Loại D vì SO2 không phản ứng.
Câu 11. Để sản xuất F2 trong công nghiệp, người ta điện phân hỗn hợp:
A. CaF2 + 2HF nóng chảy;
B. 3NaF + AlF3 nóng chảy;
C. KF + 3HF nóng chảy;
D. AlF3 + 3HF nóng chảy.
Đáp án: C
Trong công nghiệp, hỗn hợp gồm KF và HF được dùng để điện phân nóng chảy sản xuất fluorine theo tỉ lệ mol là 1:3.
Câu 12. Khi đun nóng, iodine rắn biến thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. Sự chuyển trạng thái;
B. Sự bay hơi;
C. Sự thăng hoa;
D. Sự phân hủy.
Đáp án: C
Ở nhiệt độ cao, iodine thăng hoa, chuyển từ thể rắn sang thể hơi mà không qua thể lỏng.
Câu 13. Sục một lượng khí clo vào dung dịch hỗn hợp (NaI + NaBr) thì chất được giải phóng ra trước là
A. I2;
B. Br2 ;
C. Cl2 và Br2;
D. I2 và Br2.
Đáp án: A
Iodine có tính oxi hóa kém hơn bromine nên chlorine oxi hóa muối sodium iodide thành iodine trước:
Cl2 + 2NaI → 2NaCl + I2
Câu 14. Đốt cháy hoàn toàn 28 gam bột sắt trong khí clo dư. Khối lượng muối clorua sinh ra là
A. 32,50 gam
B. 24,50 gam
C. 81,25 gam
D. 25,40 gam
Đáp án: C
nFe = ![]() = 0,5 (mol)
= 0,5 (mol)
2Fe + 3Cl2 ![]() 2FeCl3
2FeCl3
⇒ nFeCl3 = 0,5 (mol)
⇒ mFeCl3 = 0,5.162,5 = 81,25gam
Câu 15. Hòa tan hoàn toàn 86,7 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch Y. Sục khí Cl2 dư vào Y, sau khi kết thúc phản ứng, cô cạn dung dịch thu được 40,95 gam muối khan. Khối lượng của NaCl có trong X là?
A. 29,5 gam
B. 58,5 gam
C. 11,7gam
D. 23,4 gam
Đáp án: C
Gọi x, y lần lượt là số mol của NaCl và NaI trong hỗn hợp X.
⇒ 58,5x + 150y = 86,7 (1)
Cl2 + 2NaI → 2NaCl + I2
⇒ nNaCl = y (mol)
nmuối khan = nNaCl = ( mol)
⇒ x + y = 0,7 (2)
Từ (1) và (2) ta có hệ phương trình:
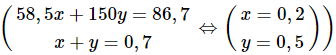
mNaCl = 0,2.58,5 = 11,7 gam.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
Bài 1: Thành phần của nguyên tử
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.