Toptailieu.vn xin giới thiệu 30 câu trắc nghiệm Ôn tập chương 6 Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
30 câu trắc nghiệm Ôn tập chương 6 Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
1. Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), …
- Tốc độ phản ứng kí hiệu là v, đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1.
2. Tốc độ trung bình của phản ứng
- Tốc độ trung bình của phản ứng (![]() ) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát: aA + bB → dD + eE
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
![]()
Trong đó: ΔCA; ΔCB; ΔCD; ΔCE lần lượt là biến thiên lượng các chất A, B, D, E trong khoảng thời gian Dt.
3. Các yếu tố ảnh hưởng đến tốc độ phản ứng
- Ảnh hưởng của nồng độ đến tốc độ phản ứng:
+ Thông thường, khi nồng độ tăng, tốc độ phản ứng sẽ tăng.
+ Giải thích: Khi nồng độ các chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn tới tốc độ phản ứng tăng.
- Ảnh hưởng của áp suất đến tốc độ phản ứng
+ Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
+ Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
- Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
+ Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
+ Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
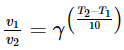
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
- Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
+ Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
+ Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
- Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
+ Chất xúc tác làm tăng tốc độ phản ứng.
+ Sau phản ứng, khối lượng và bản chất của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng hạt, độ xốp, … có thể thay đổi.
Bài tập
Câu 1. Yếu tố nào không dùng để đánh giá mức độ xảy ra phản ứng nhanh hay chậm của các phản ứng hóa học?
A. Nhiệt độ;
B. Nồng độ;
C. Thể tích khí;
D. Diện tích bề mặt chất rắn
Đáp án: C
Có 5 yếu tố ảnh hưởng đến tốc độ phản ứng:
- Nồng độ
- Áp suất
- Nhiệt độ
- Diện tích bề mặt tiếp xúc của chất
- Chất xúc tác
Câu 2. Nhận định nào dưới đây là đúng?
A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng;
B. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng đến tốc độ phản ứng;
C. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng;
D. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm.
Đáp án: A
Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả của tăng lên và dẫn đến tốc độ phản ứng tăng.
Câu 3. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
CaCO3 ![]() CaO + CO2
CaO + CO2
A. Nhiệt độ
B. Kích thước của các hạt CaCO3.
C. Áp suất;
D. Kích thước của các hạt CaO.
Đáp án: D
Kích thước của CaO không ảnh hưởng đến tốc độ phản ứng.
Câu 4. Cho phương trình hóa học: X2(k) + Y2 (k) → 2XY(k). Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ;
B. Áp suất;
C. Nồng độ;
D. Chất xúc tác.
Đáp án: B
Với phản ứng có tổng số mol khí ở hai vế bằng nhau, việc thay đổi áp suất không làm ảnh hưởng đến tốc độ phản ứng.
Câu 5. Cho phản ứng: N2 + 3H2 ![]() 2NH3
2NH3
Tốc độ phản ứng thay đổi thế nào khi giảm nồng độ của khí H2 đi 3 lần?
A. Tăng 3 lần;
B. Giảm 3 lần;
C. Tăng 9 lần;
D. Giảm 9 lần.
Đáp án: D
![]()
Khi giảm nồng độ của khí H2 đi 3 lần thì tốc độ phản ứng giảm đi 9 lần.
Câu 6. Khi tăng nhiệt độ từ 50oC đến 90oC thì tốc độ phản ứng tăng lên bao nhiêu lần, biết rằng sau khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng lên 2 lần.
A. 2;
B. 4;
C. 8;
D. 16.
Đáp án: D
Ta có: ![]() =4
=4
Tốc độ phản ứng tăng 24 = 16 lần
Câu 7. Khi áp suất tăng làm cho tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
A. Chất lỏng;
B. Chất rắn;
C. Chất khí;
D. Cả ba đều đúng.
Đáp án: C
Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Câu 8. Khi bắt đầu phản ứng, nồng độ của chất X là 0,012 mol/l. Sau 20 giây xảy ra phản ứng, nồng độ của chất đó là 0,01 mol/l. Tốc độ phản ứng trung bình là?
A. 10-2;
B. 10-3;
C. 10-4;
D. 10-5.
Đáp án: C
![]()
Câu 9. Cách nào sau đây không làm tăng diện tích bề mặt của chất rắn?
A. Đập nhỏ hạt;
B. Nghiền nhỏ hạt;
C. Tạo nhiều đường rãnh, lỗ;
D. Hòa tan chất rắn trong acid.
Đáp án: D
Hòa tan chất rắn trong acid không làm tăng diện tích bề mặt của chất rắn.
Câu 10. Yếu tố nào liên quan đến sự ảnh hưởng của xúc tác với tốc độ phản ứng?
A. Năng lượng ion hóa;
B. Năng lượng liên kết;
C. Năng lượng hoạt hóa;
D. Năng lượng phá vỡ liên kết.
Đáp án: C
Ảnh hưởng của chất xúc tác đến tốc độ phản ứng được giải thích dựa vào năng lượng hoạt hóa.
Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
Câu 11. Cho 5,6 gam iron dạng hạt vào một cốc đựng dung dịch HCl 1M (dư). Cách nào sau đây là tăng tốc độ phản ứng trên?
A. Thay iron dạng hạt bằng iron dạng bột cùng khối lượng;
B. Thay dung dịch HCl 1M bằng dung dịch HCl 0,5M;
C. Thay dung dịch HCl 1M bằng dung dịch HCl 0,25M;
D. Thực hiện phản ứng ở nhiệt độ 0oC.
Đáp án: A
Thay iron dạng hạt bằng iron dạng bột cùng khối lượng làm tăng diện tích tiếp xúc bề mặt dẫn đến tốc độ phản ứng tăng.
Câu 12. Phát biểu nào sau đây sai?
A. Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hóa học;
B. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng giảm;
C. Khi nhiệt độ phản ứng tăng, tốc độ phản ứng tăng;
D. Chất xúc tác làm tăng tốc độ phản ứng nhưng không bị biến đổi về lượng và chất sau phản ứng.
Đáp án: B
Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
Câu 13. Tại sao nhiều phản ứng hóa học trong công nghiệp cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác?
A. Ở nhiệt độ thường, tốc độ phản ứng xảy ra rất chậm nên cần thêm xúc tác và tăng nhiệt độ để tốc độ phản ứng xảy ra nhanh hơn;
B. Thêm xúc tác để tạo ra nhiều sản phẩm hơn;
C. Tăng nhiệt độ để các chất trộn đều vào nhau;
D. Giúp hiệu suất phản ứng đạt mức tối đa
Đáp án: A
Do trong công nghiệp cần sản xuất các chất với một lượng lớn, thời gian sản xuất nhanh để đạt hiệu quả kinh tế nên nên cần tốc độ phản ứng nhanh.
Ở nhiệt độ thường, tốc độ các phản ứng xảy ra chậm nên cần thêm xúc tác và tăng nhiệt độ để tốc độ phản ứng xảy ra nhanh hơn.
Câu 14. Cho phản ứng: A2 + B2 → 2AB
Biết nồng độ của chất A và chất B lần lượt là 0,2M và 0,3M. Hằng số tốc độ phản ứng là 0,8. Tốc độ phản ứng tại thời điểm ban đầu là?
A. 0,012;
B. 0,024;
C. 0,036;
D. 0,048
Đáp án: D
v = k.CA.CB = 0,8.0,2.0,3 = 0,048![]()
Câu 15. Cho phản ứng: 2NO + O2 ![]() 2NO2
2NO2
Biết nồng độ của khí NO là 0,5M và khí O2 là 0,2M. Hằng số tốc độ phản ứng là 0,3. Tốc độ phản ứng khi nồng độ khí NO giảm đi 0,2M là?
A. 2,7.10-3;
B. 1,2.10-4;
C. 5,4.10-4;
D. 10-4.
Đáp án: A
2NO + O2 ![]() 2NO2
2NO2
Theo tỉ lệ phản ứng, khi nồng độ khí NO giảm đi 0,2M thì nồng độ khí O2 giảm đi 0,1M.
⇒ Nồng độ còn lại của khí NO là: 0,5 - 0,2 = 0,3M
Nồng độ còn lại của khí O2 là: 0,2 - 0,1 = 0,1M
Tốc độ phản ứng: v = k.C2NO2.CO2 = 0,3.0.32.0,1 = 2,7.10−3![]()
Câu 16. Tốc độ phản ứng của một phản ứng hóa học là
A. đại lượng đặc trưng cho sự thay đổi số oxi hóa chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
B. đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C. thời gian để phản ứng xảy ra hoàn toàn.
D. đại lượng đặc trưng cho sự thay đổi khối lượng của các chất rắn phản ứng trong một đơn vị thời gian.
Đáp án: B
Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 17. Cho phản ứng tổng quát sau: aA + bB → mM + nN.
Công thức tính tốc độ trung bình của phản ứng ( ![]() ) nào sau đây không đúng? Biết DC, Dt lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng.
) nào sau đây không đúng? Biết DC, Dt lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng.
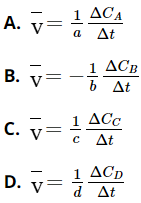
Đáp án: A
Phản ứng tổng quát: aA + bB → mM + nN.
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
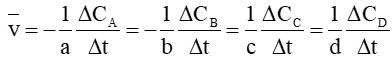
Trong đó: ∆C = C2 – C1, ∆t = t2 – t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm t1 và t2.
Câu 18. Cho phản ứng phân hủy N2O5: 2N2O5(g) → 4NO2(g) + O2(g). Biết nồng độ ban đầu của N2O5 là 0,0240M, nồng độ N2O5 sau 100s là 0,0168M. Tốc độ trung bình của phản ứng trong 100s đầu tiên là
A. 1,25×10-6 (M.s-1).
B. 1,25×10-5 (M.s-1).
C. 3,60×10-5 (M.s-1).
D. 3,60×10-6 (M.s-1).
Đáp án: C
Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
![]()
Câu 19. Phát biểu nào sau đây không đúng?
A. Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
B. Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
C. Tốc độ trung bình của phản ứng là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
D. Tốc độ phản ứng nổ của khí bình gas lớn hơn tốc độ của phản ứng gỉ sắt.
Đáp án: B
Tốc độ phản ứng chỉ nhận giá trị dương, do đó phải thêm dấu trừ trong biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Câu 20. Định luật tác dụng khối lượng: Tốc độ phản ứng
A. tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
B. tỉ lệ nghịch với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
C. tỉ lệ thuận với tích nồng độ các chất sản phẩm với số mũ thích hợp.
D. tỉ lệ nghịch với tích nồng độ các chất sản phẩm với số mũ thích hợp.
Đáp án: A
Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
Câu 21. Cho phản ứng đơn giản có dạng: aA + bB → sản phẩm. Gọi CA, CB là nồng độ mol L-1 tương ứng của chất A và B, k là hằng số tốc độ phản ứng. Tốc độ phản ứng được tính theo công thức nào sau đây?
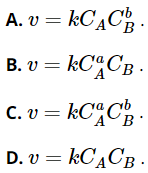
Đáp án: C
Phản ứng đơn giản có dạng: aA + bB → sản phẩm.
→ Tốc độ phản ứng được tính như sau: ![]() .
.
Câu 22. Phản ứng giữa H2 và N2 là phản ứng đơn giản: N2(g) + 3H2(g) → 2NH3(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng trên được viết dưới dạng:
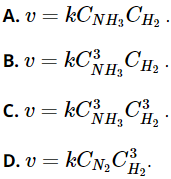
Đáp án: D
Phản ứng giữa H2 và N2: N2(g) + 3H2(g) → 2NH3(g).
Theo định luật tác dụng khối lượng, tốc độ của phản ứng trên được viết dưới dạng: ![]() .
.
Câu 23. Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi
A. nồng độ các chất phản ứng bằng nhau.
B. nồng độ các chất phản ứng bằng nhau và bằng 1M.
C. khối lượng của các chất phản ứng bằng nhau.
D. nồng độ các chất sản phẩm bằng nhau và bằng 1M.
Đáp án: B
Phản ứng đơn giản có dạng: aA + bB → sản phẩm.
Tốc độ phản ứng được tính như sau: ![]() .
.
→ Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M. Đây chính là ý nghĩa của hằng số tốc độ phản ứng.
Câu 24. Giá trị của hằng số tốc độ phản ứng (k) phụ thuộc vào
A. nhiệt độ và bản chất các chất phản ứng.
B. nhiệt độ và áp suất.
C. áp suất và bản chất các chất phản ứng.
D. nhiệt độ và độ ẩm.
Đáp án: A
Giá trị của hằng số tốc độ phản ứng (k) phụ thuộc vào nhiệt độ và bản chất các chất phản ứng.
Câu 25. Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) → 2HI(g). Nếu nồng độ của H2 tăng lên 3 lần thì tốc độ phản ứng thay đổi như thế nào?
A. tăng lên 3 lần.
B. giảm đi 3 lần.
C. tăng lên 9 lần.
D. giảm đi 9 lần.
Đáp án: A
Phản ứng của H2 và I2: H2(g) + I2(g) → 2HI(g).
→ Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng: v = kCH2CI2
Nếu nồng độ H2 tăng lên 3 lần thì tốc độ phản ứng khi đó là:
v1 = k(3CH2)CI2 = 3 × kCH2CI2 = 3v
→ Tốc độ phản ứng tăng lên 3 lần.
Câu 26. Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: D
Có 5 yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác.
Câu 27. Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 2M dư.
Thí nghiệm 2: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 0,5M dư.
So sánh tốc độ phản ứng ở hai thí nghiệm trên.
A. Tốc độ phản ứng của thí nghiệm 1 nhỏ hơn thí nghiệm 2.
B. Tốc độ phản ứng của thí nghiệm 1 lớn hơn thí nghiệm 2.
C. Tốc độ phản ứng của hai thí nghiệm bằng nhau.
D. Không thể so sánh được tốc độ phản ứng của hai thí nghiệm.
Đáp án: B
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
→ Nồng độ của H2SO4 ở thí nghiệm 1 (2M) lớn hơn ở thí nghiệm 2 (0,5M) → Tốc độ phản ứng của thí nghiệm 1 lớn hơn thí nghiệm 2.
Câu 28. Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng
A. càng nhỏ.
B. càng ổn định.
C. càng lớn.
D. tăng gấp đôi.
Đáp án: C
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
Câu 29. Cho 4 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện sau đây:
(a) Thay 4 gam kẽm hạt bằng 4 gam kẽm bột.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 4M.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
(d) Dùng thể tích dung dịch H2SO4 2M gấp đôi ban đầu.
Số trường hợp làm tăng tốc độ phản ứng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
(a) Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
Thay 4 gam kẽm hạt bằng 4 gam kẽm bột → Làm tăng diện tích bề mặt tiếp xúc giữa kẽm và dung dịch H2SO4 → Làm tăng tốc độ phản ứng.
(b) Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 4M → Nồng độ của H2SO4 tăng lên → Làm tăng tốc độ phản ứng.
(c) Nhiệt độ phản ứng càng cao, tốc độ phản ứng càng lớn.
→ Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC) → Làm tăng tốc độ phản ứng.
(d) Dùng thể tích dung dịch H2SO4 2M gấp đôi ban đầu → Nồng độ dung dịch H2SO4 không thay đổi → Tốc độ phản ứng không thay đổi.
Vậy: Có 3 trường hợp làm tăng tốc độ phản ứng.
Câu 30. Cho các phát biểu sau:
(1) Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị γ = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
(2) Chất xúc tác làm tăng tốc độ phản ứng, sau phản ứng khối lượng chất xúc tác giảm đi.
(3) Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng lên 16 lần.
(4) Thức ăn chậm bị ôi, thiu hơn khi được bảo quản trong tủ lạnh.
(5) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa khoảng 21% thể tích oxygen).
Trong các phát biểu trên, số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: B
Phát biểu đúng: (1), (4), (5).
Phát biểu (2) không đúng, vì: Chất xúc tác làm tăng tốc độ phản ứng, mà sau phản ứng nó không bị thay đổi cả về lượng và chất.
Phát biểu (3) không đúng, vì: ![]() = 23 =8 → Tốc độ phản ứng tăng lên 8 lần.
= 23 =8 → Tốc độ phản ứng tăng lên 8 lần.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.