Với giải Câu hỏi trang 63 SGK Hoá học10 Cánh Diều Bài 11: Liên kết cộng hoá trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 63 Bài 11: Liên kết cộng hoá trị
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử khi đó là liên kết cộng hóa trị không cực.
(b) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(c) Cặp electron dùng chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.
(d) Cặp electron dùng chung được tạo nên từ 2 electron hóa trị.
Lời giải:
Phát biểu đúng là: (b), (d)
(a) Sai.
Sửa lại:
Nếu cặp electron chung bị lệch về phía một nguyên tử khi đó là liên kết cộng hóa trị có cực.
(b) Đúng.
(c) Sai
Sửa lại:
Cặp electron chung có thể được tạo nên từ 2 electron của cùng một nguyên tử (liên kết cho nhận) hoặc được tạo nên từ 2 electron của hai nguyên tử khác nhau, trong đó mỗi nguyên tử góp chung 1 electron.
(d) Đúng.
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Liên kết đôi được tạo nên từ hai liên kết σ.
(b) Liên kết ba được tạo nên từ 2 liên kết σ và 1 liên kết π.
(c) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(d) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Lời giải:
Phát biểu đúng: (c), (d)
Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Lời giải:
Công thức Lewis của H2O:
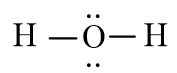
Phân tử H2O có 2 cặp electron hóa trị riêng.
Công thức Lewis của CH4
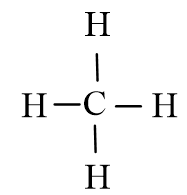
Phân tử CH4 không có cặp electron hóa trị riêng.
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở phụ lục 2:
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) mỗi chất trong hai chất trên ứng với một trong hai nhiệt độ sau: 400oC hoặc 1 000oC. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Lời giải:
a)
- Công thức phân tử của H2S là H-S-H
⇒ Phân tử H2S gồm hai liên kết S-H.
Tổng năng lượng liên kết trong phân tử H2S là: 2.368 = 736 kJ mol-1
- Công thức phân tử của H2O là H-O-H
⇒ Phân tử H2O gồm hai liên kết O-H
Tổng năng lượng liên kết trong phân tử H2O là: 2.464 = 928 kJ mol-1
b) Năng lượng liên kết trong phân tử H2O lớn hơn H2S (928 kJ mol-1 > 736 kJ mol-1)
⇒ Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) H2O lớn hơn H2S
⇒ Nhiệt độ phân hủy của H2O là 1000oC, của H2S là 400oC
Bài 5 trang 63 Hóa học 10: Khi phản ứng với H2, các phân tử như F2, N2 cần phải phá vỡ liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
Lời giải:
Năng lượng liên kết F-F là 159 kJ mol-1
Năng lượng liên kết N≡N là 946 kJ mol-1
⇒ Năng lượng cần để phá vỡ liên kết N≡N lớn hơn năng lượng cần để phá vỡ liên kết F-F
⇒ Phản ứng của F2 với H2 sẽ thuận lợi hơn.
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Câu hỏi 6 trang 59 Hóa học 10: Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet?...
Luyện tập 2 trang 59 Hóa học 10: Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H+...
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?...
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?...
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở phụ lục 2...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hoá - khử
Bài 14: Phản ứng hoá học học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.