Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Cánh diều) Bài 6: Sulfur và sulfur dioxide hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
Hoá học 11 (Cánh diều) Bài 6: Sulfur và sulfur dioxide
Lời giải:
Sulfur được dùng để bảo quản được liệu, thực phẩm khô … bằng cách đốt lưu huỳnh xông (dân gian còn gọi là quá trình “xông sinh”). Tuy nhiên, việc đốt lưu huỳnh sinh ra khí độc SO2 gây nhiễm độc thực phẩm, dược liệu … ảnh hưởng đến sức khoẻ con người.
Lời giải:
Trong tự nhiên, phần lớn sulfur tồn tại ở dạng hợp chất trong thành phần của các khoáng vật, như pyrite (thành phần chính là FeS2), sphalerite (thành phần chính là ZnS), thạch cao (thành phần chính là CaSO4), barite (thành phần chính là BaSO4), …
Các hợp chất này đều khó tan trong nước.
Thí nghiệm 1 trang 40 Hoá học 11: Tính oxi hoá của sulfur
Chuẩn bị: Bột sulfur, bột sắt, giấy lọc, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn, giá thí nghiệm
Tiến hành: Trộn đều hỗn hợp gồm khoảng 1 gam bột sắt và 0,6 gam bột sulfur trên mảnh giấy lọc. Cho hỗn hợp vào ống nghiệm chịu nhiệt, đặt ống nghiệm lên giá thí nghiệm. Đun nóng ống nghiệm trên ngọn lửa đèn cồn cho đến khi hỗn hợp “chảy” và hoá đen.
Yêu cầu: Viết phương trình hoá học của phản ứng đã diễn ra và cho biết vai trò của các chất trong phản ứng.
Lời giải:
Phương trình hoá học: 0Fe + 0Sto→+2Fe−2S
Số oxi hoá của Fe tăng từ 0 lên +2 sau phản ứng nên Fe đóng vai trò là chất khử;
Số oxi hoá của S giảm từ 0 xuống -2 sau phản ứng nên S đóng vai trò là chất oxi hoá
Thí nghiệm 2 trang 40 Hoá học 11: Tính khử của sulfur
Chuẩn bị: Bột sulfur, giấy quỳ tím, muỗng đốt hoá chất (đã xuyên qua nút cao su), bình tam giác (loại nhỏ) chứa nước và khí oxygen.
Tiến hành: Dùng muỗng đốt hóa chất (đã được xuyên qua nút cao su) lấy một ít bột sulfur (khoảng 1/2 muỗng). Đeo khẩu trang. Đốt muỗng chứa sulfur trên ngọn lửa đèn cồn. Khi sulfur cháy thì đưa nhanh muỗng đốt vào bình tam giác chứa sẵn khí oxygen và một ít nước. Đậy kín bình bằng cách di chuyển nhanh nút cao su trên muỗng vào miệng bình. Khi ngọn lửa trong bình đã tắt thì lắc nhẹ bình rồi để yên khoảng 1 phút. Dùng giấy quỳ tím thử pH của dung dịch trong bình tam giác.
Yêu cầu: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình thí nghiệm. Giải thích các hiện tượng quan sát được.
Lời giải:
- Sulfur (lưu huỳnh) cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong bình khí oxygen mãnh liệt hơn. Sản phẩm tạo thành là khí sulfur dioxide (SO2).
Phương trình hoá học: S + O2 to→ SO2.
- Thử pH của dung dịch trong bình tam giác thấy dung dịch trong bình tam giác có môi trường acid, do khí SO2 là acidic oxide, tác dụng với nước tạo môi trường acid.
Phương trình hoá học: SO2 + H2O → H2SO3.
Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Lời giải:
Sulfur dioxide thể hiện đầy đủ các tính chất của acidic oxide như phản ứng với nước tạo môi trường acid, phản ứng với basic oxide hoặc base tạo thành muối.
Vậy sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide. Phương trình hoá học minh hoạ:
SO2 + Ca(OH)2 (dư) → CaSO3 + H2O;
SO2 + CaO → CaSO3.
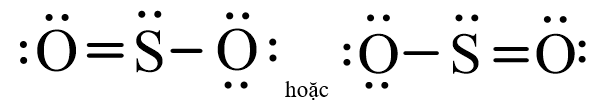
Luyện tập 2 trang 41 Hoá học 11: Hãy đề nghị công thức Lewis của SO2.
Lời giải:
Công thức Lewis của SO2:
Lời giải:
Trong hợp chất sulfur dioxide (SO2), nguyên tố sulfur có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, SO2 có thể bị khử hoặc bị oxi hoá.
FeS2 + O2 → Fe2O3 + (A)

Lời giải:
Chất A là SO2.
Ta có các quá trình:
Vậy phương trình hoá học được cân bằng:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2.
Lời giải:
- Một số biện pháp giảm thải lượng sulfur dioxide vào không khí và cơ sở hoá học của nó:
+ Thay thế dần các nhiên liệu hoá thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen, … kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
Cơ sở của biện pháp: Giảm nguồn phát sinh khí SO2.
+ Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải ra môi trường.
Cơ sở của biện pháp: Xử lí khí thải trước khi thải ra môi trường.
+ Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống, vôi tôi hoặc đá vôi nghiền…
Cơ sở của biện pháp: Tái chế các sản phẩm phụ có chứa sulfur.
SO2 + CaO → CaSO3;
SO2 + Ca(OH)2 → CaSO3 + H2O …
Lời giải:
- H2 được coi là nhiên liệu xanh (thân thiện với môi trường) do không thải ra khí gây ô nhiễm trong quá trình đốt cháy hoặc trong quá trình sản xuất; dễ lưu trữ và vận chuyển…
- Ethanol được coi là nhiên liệu xanh (thân thiện với môi trường) do khi cháy hoặc quá trình sản xuất không sinh ra tro, bụi. Ngoài ra nhiên liệu ethanol sinh học có nguồn gốc thực vật nên có khả năng tái tạo. Lượng CO2 sinh ra trong quá trình đốt cháy ethanol sinh học được cây nguyên liệu hấp thụ và cây nguyên liệu này lại dùng để chế biến ethanol sinh học. Như vậy xét theo chu trình khép kín thì lượng CO2 thải ra môi trường giảm đáng kể.

Lời giải:
Phương trình hoá học chứng minh sulfur có tính oxi hoá:
Phương trình hoá học chứng minh sulfur có tính khử:
Phương trình hoá học chứng minh sulfur dioxide có tính oxi hoá:
Phương trình hoá học chứng minh sulfur dioxide có tính khử:
Lời giải:
Sulfur dioxide là acidic oxide – mang đầy đủ tính chất hoá học của một acidic oxide như tác dụng với nước, basic oxide, base. Do đó nhằm hạn chế phát tán sulfur dioxide ra môi trường, ta có thể dùng dung dịch sodium hydroxide, dung dịch nước vôi trong để hấp thụ khí này.
SO2 + Ca(OH)2 → CaSO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O.
a) Viết phương trình hoá học của các phản ứng trên.
b) Ở mỗi phản ứng, sulfur dioxide thể hiện tính chất gì?
Lời giải:
a) Các phương trình hoá học minh hoạ:
SO2(g) + CaO(s) → CaSO3(s);
SO2(g) + Ca(OH)2(aq) → CaSO3(s) + H2O(l).
b) Trong các phản ứng trên, vai trò của sulfur dioxide là acidic oxide.
Xem thêm các bài giải Hoá học 11 Cánh diều hay, chi tiết khác:
Hoá học 11 (Cánh diều) Bài 4: Đơn chất nitrogen
Hoá học 11 (Cánh diều) Bài 5: Một số hợp chất quan trọng của nitrogen
Hoá học 11 (Cánh diều) Bài 7: Sulfuric acid và muối sulfate
Hoá học 11 (Cánh diều) Bài 8: Hợp chất hữu cơ và hoá học hữu cơ
Hoá học 11 (Cánh diều) Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.