Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Cánh diều) Bài 16: Alcohol hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
Hoá học 11 (Cánh diều) Bài 16: Alcohol
Lời giải:
X là CH3CH2OH (ethanol).
Câu hỏi 1 trang 108 Hóa học 11: Cho các chất A, B, C, D và E có công thức cấu tạo như sau:
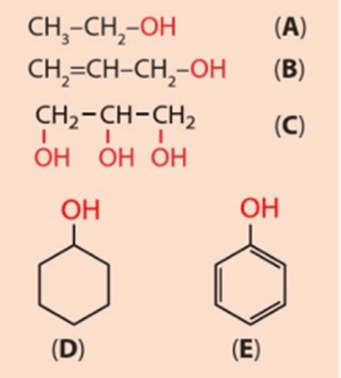
a) Hãy nhận xét đặc điểm chung về cấu tạo của các chất trên.
b) Hợp chất E có phải là alcohol không?
Lời giải:
a) Trong phân tử các chất trên đều có chứa nhóm – OH.
b) Chất E không phải là alcohol do có nhóm – OH liên kết trực tiếp với C không no.
Lời giải:
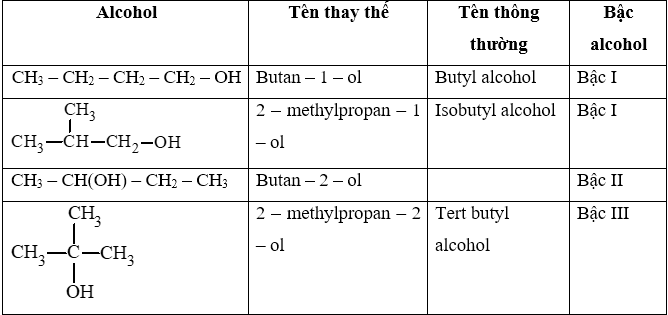
Các alcohol có công thức phân tử C4H10O:
Chất X được sử dụng rộng rãi làm chất chống đông và làm nguyên liệu trong sản xuất poly(ethylene terephtalate). Chất X có thể điều chế bằng cách oxi hoá trực tiếp ethylene bằng dung dịch potassium permanganate. Xác định công thức cấu tạo của X, gọi tên X theo tên thay thế và tên thông thường.
Lời giải:
Công thức cấu tạo của X:
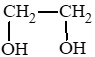
Tên thay thế: ethane – 1,2 – diol.
Tên thông thường: ethylene glycol.
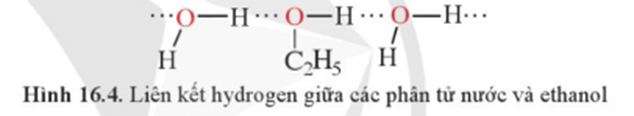
Luyện tập 3 trang 110 Hóa học 11: Vì sao ethanol có khả năng tan vô hạn trong nước?
Lời giải:
Ethanol có khả năng tan vô hạn trong nước do có thể tạo được liên kết hydrogen với nước.
Lời giải:
Dự đoán nhiệt độ sôi các chất như sau:
|
Chất |
C2H6 |
C2H5Cl |
C2H5OH |
C6H5CH2OH |
|
to sôi |
-89 oC |
12,3 oC |
78,3 oC |
205 oC |
Giải thích dự đoán:
- Do tạo được liên kết hydrogen liên phân tử nên các alcohol có nhiệt độ sôi cao hơn các hydrocarbon hoặc dẫn xuất halogen có phân tử khối tương đương.
- Nhiệt độ sôi của các alcohol tăng dần khi phân tử khối tăng.
Lời giải:
Đun hỗn hợp methanol và ethanol với dung dịch sulfuric acid đặc ở nhiệt độ thích hợp thì thu được những ether sau: CH3OCH3; C2H5OC2H5; CH3OC2H5.
Các phương trình hoá học của các phản ứng xảy ra:
2CH3OH H2SO4,140oC→ CH3OCH3 + H2O
2C2H5OH H2SO4,140oC→ C2H5OC2H5 + H2O
CH3OH + C2H5OH H2SO4,140oC→ CH3OC2H5 + H2O.
Lời giải:
Alkene thu được khi đun đun propan-1-ol và propan-2-ol với dung dịch sulfuric acid đặc là giống nhau.
Các phương trình hoá học của phản ứng xảy ra:
CH3 – CH2 – CH2 – OH H2SO4,170oC→ CH3 – CH = CH2 + H2O
CH3 – CH(OH) – CH3 H2SO4,170oC→ CH2 = CH – CH3 + H2O.
Thí nghiệm 1 trang 111 Hóa học 11: Đốt cháy ethyl alcohol
Chuẩn bị: Cồn 96°, đĩa sứ hoặc bát sứ.
Tiến hành: Nhỏ khoảng 1 – 2 mL cồn vào đĩa sứ hoặc bát sứ. Dùng que đóm châm lửa rồi tiến hành đốt cồn trong đĩa.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.
Chú ý an toàn: Do ethanol có thể cháy lan rộng nên không được lấy quá nhiều cồn, không được đốt cồn bằng diêm hoặc bật lửa.
Lời giải:
Hiện tượng: Ethanol cháy mạnh trong không khí, phản ứng toả nhiều nhiệt.
Phương trình hoá học:
C2H5OH(l) + 3O2(g) to→ 2CO2(g) + 3H2O(g).
Lời giải:
Phương trình hoá học minh hoạ:
CH3 – CH2 – CH2 – OH + CuO to→ CH3 – CH2 – CH = O + Cu + H2O.
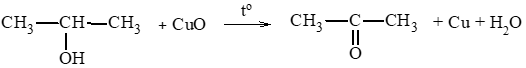
Lời giải:
Đánh số thứ tự từng ống nghiệm, trích mẫu thử.
Cho lần lượt từng mẫu thử phản ứng với dung dịch bromine.
+ Dung dịch bromine nhạt dần đến mất màu → mẫu thử là allyl alcohol.
CH2 = CH – CH2 – OH + Br2 → CH2Br – CHBr – CH2 – OH.
+ Không có hiện tượng gì xuất hiện → mẫu thử là ethanol và glycerol (nhóm I).
Cho lần lượt từng mẫu thử ở nhóm I tác dụng với copper(II) hydroxide.
+ Copper(II) hydroxide tan dần, sau phản ứng thu được dung dịch xanh lam → glycerol.
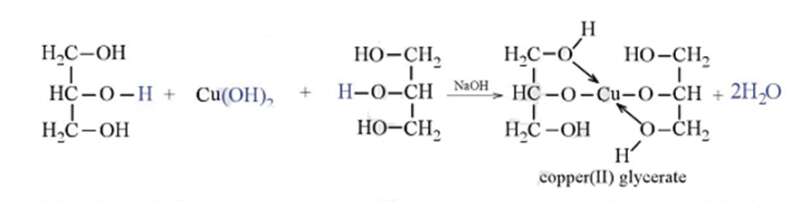
+ Không có hiện tượng: ethanol.
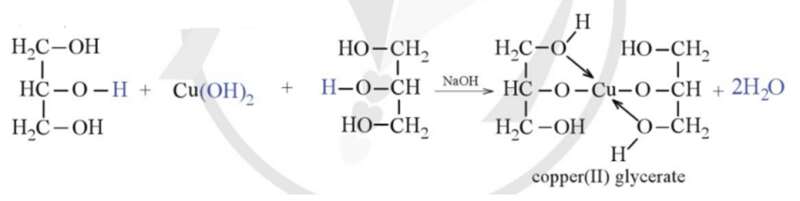
Thí nghiệm 2 trang 112 Hóa học 11: Hoà tan copper(II) hydroxide bằng glycerol
Chuẩn bị: dung dịch CuSO4 5%, dung dịch NaOH 20%, ethanol, glycerol; ống nghiệm.
Tiến hành: Chuẩn bị hai ống nghiệm, cho vào mỗi ống nghiệm có chứa 3 – 4 giọt dung dịch copper(II) sulfate 5% và 1 mL dung dịch sodium hydroxide 20%, lắc nhẹ. Tiếp tục nhỏ vào ống nghiệm thứ nhất 3 – 4 giọt ethanol, vào ống nghiệm thứ hai 3 – 4 giọt glycerol. Lắc nhẹ cả hai ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích.
Lời giải:
Hiện tượng:
+ Sau khi nhỏ vào mỗi ống nghiệm 3 – 4 giọt dung dịch copper(II) sulfate 5% và 1 mL dung dịch sodium hydroxide 20%, lắc nhẹ thấy có kết tủa xanh xuất hiện.
+ Tiếp tục nhỏ vào ống nghiệm thứ nhất 3 – 4 giọt ethanol, lắc nhẹ không thấy có hiện tượng gì xuất hiện.
+ Tiếp tục nhỏ vào ống nghiệm thứ hai 3 – 4 giọt glycerol, lắc nhẹ thấy kết tủa tan dần, thu được dung dịch có màu xanh lam đặc trưng.
Giải thích hiện tượng bằng phương trình hoá học:
CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq).
C2H5OH + Cu(OH)2 → không phản ứng.
Câu hỏi 3 trang 113 Hóa học 11: Vì sao ethanol được sử dụng để làm nhiên liệu?
Lời giải:
Do phản ứng đốt cháy ethanol toả nhiều nhiệt nên ethanol được dùng làm nhiên liệu cho các đèn cồn trong phòng thí nghiệm, được pha vào xăng dùng cho động cơ đốt trong.
Lời giải:
- Xăng E5 là xăng có 5% ethanol theo thể tích.
- Xăng được trộn thêm 1 lượng ethanol lại được gọi là xăng sinh học vì lượng ethanol dùng để phối trộn xăng được chế biến thông qua lên men các sản phẩm hữu cơ như tinh bột, cellulose … thường là từ các loại ngũ cốc như ngô, lúa mì, đậu tương hoặc từ vỏ cây, bã mía (chất thải sản xuất)…
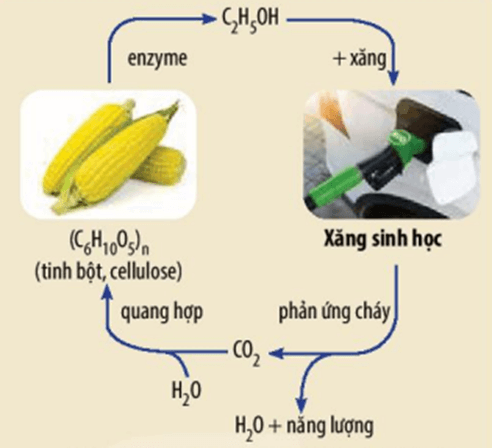
Chu trình khép kín của ethanol trong xăng sinh học
Lời giải:
Hậu quả của sử dụng rượu bia khi tham gia giao thông: Rượu bia khiến hệ thần kinh mất khả năng tự chủ, mất khả năng định hướng, mất khả năng điều khiển vận động. Từ đó dẫn tới việc lái xe không an toàn, không còn xử lý tình huống được như ý muốn nữa gây mất an toàn giao thông.
Cụ thể, do không kiểm soát được nhận thức và hành vi bởi tác động của chất kích thích trong cơ thể, người sử dụng rượu bia thường không làm chủ được tay lái, có xu hướng phóng nhanh, vượt ẩu, không chấp hành tín hiệu đèn và hay ngủ gật khi đang điều khiển phương tiện dễ dẫn đến người điều khiển tự gây tai nạn (do tông vào dải phân cách, gốc cây, trụ điện, các xe khác đang dừng đỗ…) hoặc gây tai nạn với các phương tiện khác. Đây chính là nguyên nhân dẫn đến các thương tật nặng nề, cái chết đau lòng cho người tham gia giao thông.
Ý kiến cá nhân của em về việc này: Đã uống rượu bia thì không lái xe.

Lời giải:
Ethanol được điều chế bằng phương pháp lên men các nguyên liệu chứa nhiều tinh bột hoặc đường như ngũ cốc (gạo, ngô, khoai, sắn …), quả chín (nho, anh đào…). Quá trình lên men này được tóm tắt như sau:
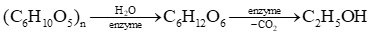
Ở nhiều nước có nền công nghiệp hoá chất phát triển, ethanol được điều chế bằng phản ứng hydrate hoá ethylene với xúc tác H2SO4 đặc hoặc H3PO4.
C2H4 + H2O H2SO4,to→ C2H5OH
Ở địa phương em ethanol được sản xuất bằng phương pháp truyền thống, lên men các nguyên liệu chứa nhiều tinh bột hoặc đường như ngũ cốc (gạo, ngô, khoai, sắn …). Phương pháp này có các ưu điểm và nhược điểm sau:
- Ưu điểm: Giữ nguyên vị thơm của nguyên liệu.
- Nhược điểm: Giá thành cao hơn so với rượu sản xuất công nghiệp. Ngoài ra, việc sản xuất rượu theo hộ gia đình có thể không đảm bảo điều kiện vệ sinh an toàn thực phẩm hoặc không đảm bảo độ tinh khiết của rượu.
Lời giải:
Sơ đồ điều chế glycerol từ propene:
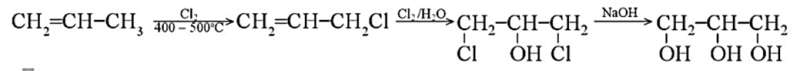
Phương trình hoá học minh hoạ:
(1) CH2 = CH – CH3 + Cl2 400−500oC→ CH2 = CH – CH2Cl + HCl
(2) CH2 = CH – CH2Cl + Cl2 + H2O → CH2Cl – CH(OH) – CH2Cl + HCl
(3) CH2Cl – CH(OH) – CH2Cl + 2NaOH to→ CH2OH – CH(OH) – CH2OH + 2NaCl.
Xem thêm các bài giải Hoá học 11 Cánh diều hay, chi tiết khác:
Hoá học 11 (Cánh diều) Bài 14: Arene (Hydrocarbon thơm)
Hoá học 11 ( Cánh diều ) Bài 15: Dẫn xuất halogen
Hoá học 11 ( Cánh diều ) Bài 17: Phenol
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.