Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Cánh diều) Bài 18: Hợp chất carbonyl hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
Hoá học 11 (Cánh diều) Bài 18: Hợp chất carbonyl
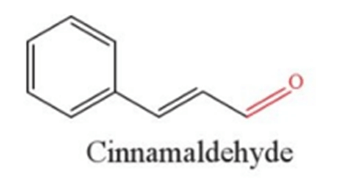
Lời giải:
Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có nhóm chức carbonyl (![]() ). Nhóm chức carbonyl có trong aldehyde, ketone …
). Nhóm chức carbonyl có trong aldehyde, ketone …
Luyện tập 1 trang 123 Hóa học 11: Cho các hợp chất có công thức sau:
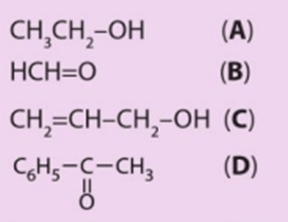
Trong các hợp chất trên, hợp chất nào là hợp chất carbonyl, hợp chất nào thuộc loại aldehyde, ketone?
Lời giải:
- Hợp chất carbonyl: (B), (D).
- Hợp chất thuộc loại aldehyde: (B).
- Hợp chất thuộc loại ketone: (D).
Câu hỏi 1 trang 123 Hóa học 11: Hãy mô tả hình dạng phân tử methanal và ethanal.
Lời giải:
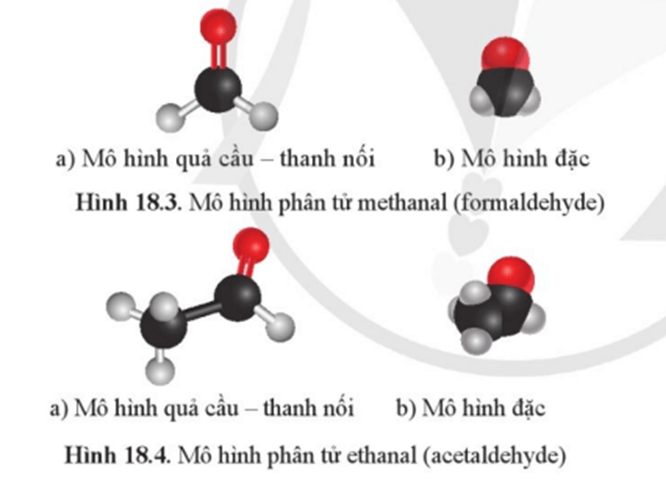
Nguyên tử C mang liên kết đôi ở trạng thái lai hoá sp2.
Liên kết đôi C = O gồm một liên kết σ bền và một liên kết π kém bền. Liên kết đôi C = O và hai liên kết đơn nằm trong cùng một mặt phẳng, góc giữa các liên kết ở nhóm ![]() xấp xỉ 120o.
xấp xỉ 120o.
Lời giải:
Các aldehyde đơn giản như formic aldehyde và acetic aldehyde có phân tử khối nhỏ, kích thước phân tử nhỏ, không tạo được liên kết hydrogen giữa các phân tử với nhau nên ở điều kiện thường chúng là các chất khí.
Lời giải:
Dự đoán nhiệt độ sôi các chất:
|
Chất |
C2H6 |
HCH = O |
CH3CH = O |
CH3CH2CH=O |
C2H5OH |
|
Nhiệt độ sôi |
-89 oC |
-21 oC |
21 oC |
49 oC |
78,3 oC |
Giải thích:
- So với các alcohol có cùng số nguyên tử carbon trong phân tử, các hợp chất carbonyl có nhiệt độ sôi thấp hơn nhiều.
- Các hợp chất carbonyl có nhiệt độ sôi cao hơn nhiều so với các hydrocarbon có phân tử khối tương đương.
- Các hợp chất carbonyl (HCH = O, CH3CH = O, CH3CH2CH=O ) có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
Lời giải:
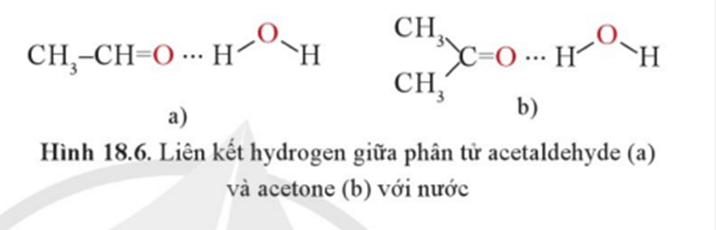
Các hợp chất carbonyl mạch ngắn như formaldehyde, acetaldehyde, acetone tan tốt trong nước nhờ tạo liên kết hydrogen với nước.
Ví dụ liên kết hydrogen giữa các phân tử acetaldehyde và acetone với nước như sau:
Lời giải:
Độ âm điện của carbon là: 2,55; độ âm điện của oxygen là: 3,44.
Nhận xét: Liên kết đôi C = O phân cực về phía nguyên tử oxygen.
Lời giải:
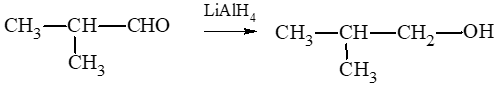
Ta có các sơ đồ:
CH3 – CH2 – CH2 – CHO LiAlH4→ CH3 – CH2 – CH2 – CH2 – OH.
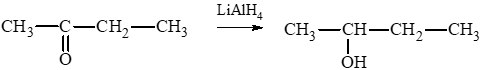
a) Thuốc thử Tollens.
b) Cu(OH)2/OH-.
Lời giải:
a) Propanal có phản ứng với thuốc thử Tollens còn propanone không có phản ứng này.
Phương trình hoá học:
CH3CH2CHO + 2[Ag(NH3)2OH] to→ CH3CH2COONH4 + 2Ag + 3NH3 + H2O.
b) Propanal có phản ứng với Cu(OH)2/OH- còn propanone không có phản ứng này.
CH3CH2CHO + 2Cu(OH)2 + NaOH to→ CH3CH2COONa + Cu2O + 3H2O.
Luyện tập 5 trang 128 Hóa học 11: Hãy trình bày cách phân biệt acetaldehyde và acetone.
Lời giải:
Acetone không có phản ứng với thuốc thử Tollens hoặc với Cu(OH)2 (trong môi trường kiềm) nên có thể dùng thuốc thử Tollens hoặc Cu(OH)2 để phân biệt acetaldehyde và acetone.
Cách 1: Phân biệt acetaldehyde và acetone bằng thuốc thử Tollens:
- Trích mẫu thử.
- Chuẩn bị hai ống nghiệm. Cho vào mỗi ống nghiệm khoảng 1 mL dung dịch AgNO3 1% và nhỏ từ từ từng giọt dung dịch NH3 5% và lắc nhẹ cho đến khi vừa hoà tan hết kết tủa silver oxide, thu được thuốc thử Tollens (thuốc thử Tollens sẽ kém nhạy nếu dư dung dịch NH3).
- Cho lần lượt từng mẫu thử vào từng ống nghiệm chứa thuốc thử Tollens, lắc đều các ống nghiệm. Đun nóng nhẹ hỗn hợp trong các ống nghiệm trên ngọn lửa đèn cồn.
+ Nếu có lớp bạc trắng sáng bám thành ống nghiệm mẫu thử là acetaldehyde.
+ Không có hiện tượng mẫu thử là acetone.
Cách 2: Phân biệt acetaldehyde và acetone bằng thuốc thử Cu(OH)2/OH-.
- Trích mẫu thử.
- Chuẩn bị hai ống nghiệm. Cho vào mỗi ống nghiệm khoảng 1 mL dung dịch CuSO4 2%, rồi cho tiếp khoảng 1 mL dung dịch NaOH 10%, lắc ống nghiệm.
- Nhỏ từ từ từng mẫu thử vào từng ống nghiệm rồi đun nóng nhẹ hỗn hợp trong các ống nghiệm trên ngọn lửa đèn cồn.
+ Nếu có kết tủa đỏ gạch → mẫu thử là acetaldehyde.
+ Không có hiện tượng → mẫu thử là acetone.
Thí nghiệm 1 trang 128 Hóa học 11: Phản ứng oxi hoá aldehyde bằng thuốc thử Tollens
Chuẩn bị: Dung dịch AgNO3 1%, dung dịch NH3 5%, dung dịch CH3CHO 5%; ống nghiệm.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch AgNO3 1% và nhỏ từ từ từng giọt dung dịch NH3 5% và lắc nhẹ cho đến khi vừa hoà tan hết kết tủa silver oxide, thu được thuốc thử Tollens (thuốc thử Tollens sẽ kém nhạy nếu dư dung dịch NH3).
Nhỏ vài giọt dung dịch acetaldehyde 5% vào dung dịch thuốc thử Tollens, lắc đều ống nghiệm. Đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
Hiện tượng: Có lớp bạc trắng sáng bám thành ống nghiệm.
Giải thích bằng phương trình hoá học:
AgNO3 + 3NH3 + H2O → [Ag(NH3)2]OH (thuốc thử Tollens) + NH4NO3
CH3CHO + 2[Ag(NH3)2]OH to→ CH3COONH4 + 2Ag + 3NH3 + H2O.
Thí nghiệm 2 trang 128 Hóa học 11: Phản ứng oxi hoá aldehyde bằng Cu(OH)2
Chuẩn bị: Dung dịch CuSO4 2%, dung dịch NaOH 10%, dung dịch CH3CHO 5%; ống nghiệm.
Tiến hành: Cho khoảng 1 mL dung dịch CuSO4 2% vào ống nghiệm, rồi cho tiếp khoảng 1 mL dung dịch NaOH 10%. Lắc ống nghiệm, nhỏ từ từ khoảng 1 mL dung dịch CH3CHO vào ống nghiệm. Đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
Hiện tượng:
- Cho khoảng 1 mL dung dịch CuSO4 2% vào ống nghiệm, rồi cho tiếp khoảng 1 mL dung dịch NaOH 10% thấy xuất hiện kết tủa xanh.
- Thêm tiếp CH3CHO vào ống nghiệm, đun nóng nhẹ thấy xuất hiện kết tủa đỏ gạch.
Giải thích bằng phương trình hoá học:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH to→ CH3COONa + Cu2O (đỏ gạch) + 3H2O.
Lời giải:
Trong phản ứng tráng bạc, người ta không đun sôi hỗn hợp phản ứng để cho bạc bám đều lên thành ống nghiệm (hoặc vật cần tráng bạc).
Thí nghiệm 3 trang 129 Hóa học 11: Phản ứng tạo iodoform
Chuẩn bị: Dung dịch I2 trong KI, dung dịch NaOH 10%, acetaldehyde; ống nghiệm.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch I2 trong KI và khoảng 1 mL dung dịch NaOH 10%. Nhỏ từ từ 5 – 7 giọt acetaldehyde vào ống nghiệm. Lắc đều.
Yêu cầu: Quan sát hiện tượng xảy ra trong ống nghiệm và giải thích.
Lời giải:
Hiện tượng: Sau phản ứng xuất hiện kết tủa màu vàng.
Giải thích: Acetaldehyde là hợp chất có chứa nhóm methyl ketone phản ứng với iodine trong môi trường kiềm tạo ra kết tủa iodoform (triiodomethane) màu vàng.
Phương trình hoá học:
CH3CHO + 3I2 + 4NaOH → CHI3 (kết tủa vàng) + HCOONa + 3NaI + 3H2O.
Lời giải:
+ Formaldehyde được dùng chủ yếu để sản xuất nhựa như poly(phenol – formaldehyde) và urea formaldehyde. Formaldehyde cũng được sử dụng để sản xuất phẩm nhuộm, chất nổ và dược phẩm. Dung dịch 37% - 40% formaldehyde trong nước, được gọi là formalin, được dùng để ngâm xác động thực vật, tẩy uế, tiệt trùng.
+ Acetaldehyde (ethanal) được dùng nhiều trong tổng hợp hữu cơ để điều chế nhiều dược phẩm hoặc các chất có ứng dụng trong thực tiễn. Ví dụ từ acetaldehyde, người ta điều chế được ethylidene diacetate dùng để sản xuất poly(vinyl acetate).
+ Acetone có thể hoà tan tốt nhiều chất hữu cơ khác nhau (kể cả các polymer như cellulose trinitrate). Vì vậy một lượng lớn acetone được dùng làm dung môi trong sản xuất tơ nhân tạo, thuốc súng không khói … Ngoài ra, acetone còn được dùng nhiều trong tổng hợp hữu cơ như để tổng hợp bisphenol – A, chloroform, thuốc an thần solfonal, …
Bài 1 trang 131 Hóa học 11: Công thức cấu tạo của acetone là
A. CH3COCH2CH3.
B. CH3CH2COCH2CH3.
C. CH3COCH3.
D. CH3CHO.
Lời giải:
Đáp án đúng là: C
Acetone: CH3COCH3.
Bài 2 trang 131 Hóa học 11: Khử CH3COCH3 bằng LiAlH4 thu được sản phẩm là
A. ethanal.
B. acetone.
C. propan – 1 – ol.
D. propan – 2 – ol.
Lời giải:
Đáp án đúng là: D
CH3COCH3 LiAlH4→ CH3CH(OH)CH3.
Lời giải:
Các aldehyde có cùng công thức C5H10O:
CH3CH2CH2CH2CHO: pentanal.
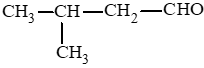 : 3 – methylbutanal
: 3 – methylbutanal
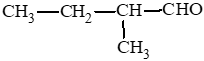 : 2 – methylbutanal
: 2 – methylbutanal
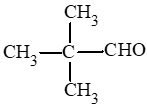 : 2,2 – dimethylpropanal.
: 2,2 – dimethylpropanal.
Lời giải:
Công thức cấu tạo của các chất carbonyl có công thức phân tử C3H6O là:
CH3CH2CHO: propanal.
CH3COCH3: propanone.
Cách 1: Phân biệt propanal và propanone bằng thuốc thử Tollens:
|
Chất |
CH3CH2CHO |
CH3COCH3 |
|
Hiện tượng với thuốc thử Tollens |
Kết tủa bạc |
Không hiện tượng |
Phương trình hoá học:
CH3CH2CHO + 2[Ag(NH3)2OH] to→ CH3CH2COONH4 + 2Ag + 3NH3 + H2O.
Cách 2: Phân biệt propanal và propanone bằng thuốc thử Cu(OH)2/OH-.
|
Chất |
CH3CH2CHO |
CH3COCH3 |
|
Hiện tượng với thuốc thử Cu(OH)2/OH- |
Kết tủa đỏ gạch |
Không hiện tượng |
Phương trình hoá học:
CH3CH2CHO + 2Cu(OH)2 + NaOH to→ CH3CH2COONa + Cu2O + 3H2O.
Lời giải:
%O = 100% - 62,07% - 10,34% = 27,59%.
Đặt công thức chung của X là: CxHyOz, ta có:
x : y : z = %C12:%H1:%O16=62,0712:10,341:27,5916
= 5,1725 : 10,34 : 1,724 = 3 : 6 : 1.
Công thức đơn giản nhất của X là C3H6O và công thức phân tử của X có dạng: (C3H6O)n.
Peak ion phân tử [M+] có giá trị m/z bằng 58 cho thấy X có phân tử khối bằng 58.
⇒ 58n = 1 ⇒ n = 1.
Vậy công thức phân tử của X là: C3H6O.
Trên phổ IR của X có một peak trong vùng 1 670 – 1740 cm-1 nên X là hợp chất carbonyl.
Chất X không có phản ứng với Cu(OH)2 trong môi trường kiềm để tạo ra kết tủa màu đỏ gạch nên X là ketone.
Công thức cấu tạo của X là: CH3COCH3.
Lời giải:
Công thức cấu tạo của:
(A): CH3CH2CHO: propanal.
(B): CH3COCH3: propanone.
(C): CH2 = CH – CH2 – OH: prop – 2 – ene – 1 – ol.
Xem thêm các bài giải Hoá học 11 Cánh diều hay, chi tiết khác:
Hoá học 11 ( Cánh diều ) Bài 16: Alcohol
Hoá học 11 ( Cánh diều ) Bài 17: Phenol
Hoá học 11 ( Cánh diều ) Bài 19: Carboxylic acid
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.