Với giải Mở đầu trang 62 KHTN 8 Chân trời sáng tạo chi tiết trong Bài 13: Muối giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập KHTN 8. Mời các bạn đón xem:
Thạch nhũ trong các hang động có thành phần chính là muối của calcium
Mở đầu trang 62 KHTN 8: Thạch nhũ trong các hang động có thành phần chính là muối của calcium, nước biển chứa muối ăn và nhiều loại muối khác. Trong tự nhiên, các kim loại thường tồn tại dưới dạng muối. Muối là gì? Muối có thành phần tính chất và mối quan hệ với acid, base, oxide như thế nào?

Trả lời:
Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Thành phần của muối: ion kim loại (hoặc ion ammonium) và ion gốc acid.
Muối có thể tan, không tan hoặc ít tan trong nước.
Tính chất hoá học của muối:
+ Dung dịch muối phản ứng với kim loại tạo thành muối mới và kim loại mới.
+ Dung dịch muối phản ứng với dung dịch base tạo thành muối mới và base mới.
+ Dung dịch muối phản ứng với dung dịch acid tạo thành muối mới và acid mới.
+ Hai dung dịch muối phản ứng với nhau tạo thành hai muối mới.
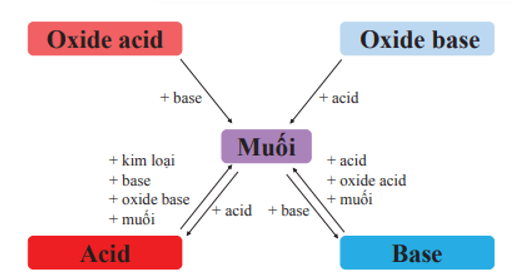
Mối quan hệ giữa acid, base, oxide và muối được thể hiện bằng sơ đồ:
Xem thêm các bài giải SGK KHTN 8 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 62 KHTN 8: Thạch nhũ trong các hang động có thành phần chính là muối của calcium, nước biển chứa muối ăn và nhiều loại muối khác
Câu hỏi thảo luận 1 trang 62 KHTN 8: Khi thay ion hydrogen trong phân tử sulfuric acid bởi mỗi ion Al3+, Cu2+ và NH4+ thì ta được những hợp chất gì? Viết công thức hoá học cho chúng.
Câu hỏi thảo luận 2 trang 62 KHTN 8: Sản phẩm thay thế ion hydrogen trong hydrochloric acid bởi ion magnesium sẽ được hợp chất gì
Luyện tập trang 63 KHTN 8: Dựa vào tên một số gốc acid ở Bảng 9.1, hoàn thành bảng theo mẫu sau:
Vận dụng trang 63 KHTN 8: (X) là muối nitrate của kim loại M. Ở điều kiện thường, (X) là chất rắn, màu trắng (hình bên) và có nhiều ứng dụng trong đời sống; biết khối lượng phân tử của (X) bằng 101 amu.
Câu hỏi thảo luận 3 trang 63 KHTN 8: Dựa vào thông tin và Bảng tính tan ở Phụ lục, hãy chọn hai kim loại thay thế hydrogen ion trong hydrochloric acid và sulfuric acid để được bốn muối đều tan trong nước
Câu hỏi thảo luận 4 trang 63 KHTN 8: Có hai muối MSO4 và MCO3 đều không tan trong nước, dựa vào bảng tính tan (Phụ lục) hãy cho biết tên của kim loại M.
Luyện tập trang 64 KHTN 8: Dựa vào bảng tính tan ở Phụ lục 1, hãy hoàn thành bảng theo mẫu sau:
Vận dụng trang 64 KHTN 8: (X) là muối carbonate của kim loại R hoá trị II. (X) có khối lượng phân tử bằng 197 amu.
Câu hỏi thảo luận 5 trang 65 KHTN 8: Tương tự các Ví dụ 2, 3, 4, 5, hãy viết phương trình hoá học tạo các muối sau: K2SO3, CaSO4, NaCl, MgCl2.
Câu hỏi thảo luận 6 trang 65 KHTN 8: Theo em, khi cho SO2 tác dụng với mỗi dung dịch: NaOH, Ba(OH)2 đều lấy dư sẽ thu được muối gì. Viết các phương trình hoá học xảy ra.
Câu hỏi thảo luận 7 trang 65 KHTN 8: Từ các phương pháp điều chế muối, hãy viết 3 phương trình hoá học tạo ra iron(II) chloride.
Luyện tập trang 65 KHTN 8: Hoàn thành bảng theo mẫu sau:
Vận dụng trang 65 KHTN 8: Sodium sulfate ở điều kiện thường là chất rắn, màu trắng, được sử dụng nhiều trong các ngành công nghiệp.
Câu hỏi thảo luận 8 trang 66 KHTN 8: Hãy nêu hiện tượng và viết phương trình hoá học của phản ứng ở Thí nghiệm 1.
Luyện tập trang 66 KHTN 8: Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
Câu hỏi thảo luận 9 trang 66 KHTN 8: Hãy nêu hiện tượng của Thí nghiệm 2 và đề xuất 3 phương trình hoá học khác tạo ra copper(II) hydroxide.
Luyện tập trang 67 KHTN 8: Cho các dung dịch sau phản ứng với nhau, hoàn thành các phương trình hoá học:
Câu hỏi thảo luận 10 trang 67 KHTN 8: Hãy nêu hiện tượng của Thí nghiệm 3 và giải thích.
Luyện tập trang 67 KHTN 8: Hãy tìm 2 muối phản ứng được với dung dịch HCl và dung dịch H2SO4. Viết các phương trình hoá học của phản ứng đã xảy ra.
Câu hỏi thảo luận 11 trang 67 KHTN 8: Nêu hiện tượng của Thí nghiệm 4. Từ đó, viết các phương trình hoá học sau:
Luyện tập trang 67 KHTN 8: Hãy tìm 3 dung dịch muối có thể phản ứng được với dung dịch Na2CO3. Viết các phương trình hoá học của phản ứng xảy ra.
Vận dụng trang 68 KHTN 8: Để làm sạch lớp cặn (thường là CaCO3) trong các dụng cụ đun nước, người ta dùng giấm ăn hoặc nước ép từ quả chanh. Giải thích.
Câu hỏi thảo luận 12 trang 68 KHTN 8: Hãy chọn chất thích hợp và viết các phương trình hoá học theo sơ đồ ở Hình 13.7.
Luyện tập trang 68 KHTN 8: Hãy viết phương trình hoá học của các phản ứng xảy ra theo sơ đồ sau:
Xem thêm các bài giải SGK KHTN 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Thang pH
Bài 12: Oxide
Bài 14: Phân bón hoá học
Ôn tập chương 2
Bài 15: Khối lượng riêng

