Với giải Luyện tập trang 58 Hóa học 11 Chân trời sáng tạo chi tiết trong Bài 10: Công thức phân tử hợp chất hữu cơ giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Hoá học 11. Mời các bạn đón xem:
Một hợp chất hữu cơ Y có 32% C; 6,67% H; 18,67% N về khối lượng còn lại là O
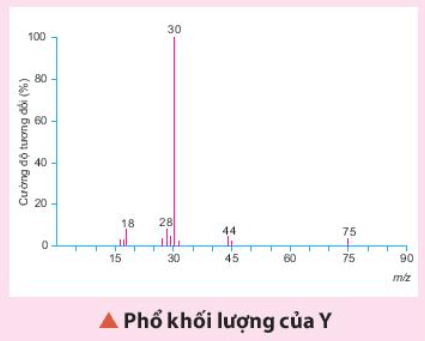
Luyện tập trang 58 Hóa học 11: Một hợp chất hữu cơ Y có 32% C; 6,67% H; 18,67% N về khối lượng còn lại là O. Phân tử khối của hợp chất này được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất. Lập công thức phân tử của Y.
Lời giải:
%mO = 100% - 32% - 6,67% - 18,67% = 42,66%.
Đặt công thức phân tử của Y là CxHyOzNt.
Từ phổ khối lượng của Y xác định được: MY = 75.
Vậy:
Công thức phân tử của Y: C2H5O2N.
Xem thêm các bài giải SGK Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các bài giải SGK Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.