Toptailieu.vn xin giới thiệu Lý thuyết Ammonia và một số hợp chất ammonium (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Lý thuyết Ammonia và một số hợp chất ammonium (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11
Bài giải Bài 4: Ammonia và một số hợp chất ammonium
A. Lý thuyết Ammonia và một số hợp chất ammonium
1. Cấu tạo của phân tử Ammonia
- Amoniac là một hợp chất vô cơ được cấu tạo từ 3 nguyên tử nitơ và 1 nguyên tử hidro tạo thành liên kết kém bền.
- Cấu tạo của phân tử Ammonia:
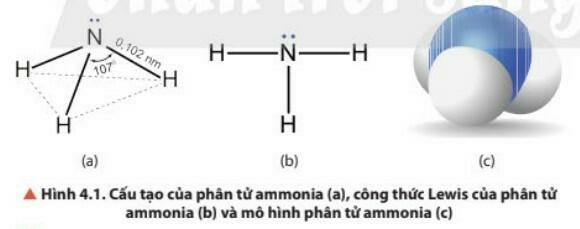
- NH3: có cấu trúc tóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen
2. Tính chất của Ammonia
a. Tìm hiểu tính chất vật lí của Ammonia
- Ammonia là chất khí không màu, có mùi khai, xốc và nhẹ hơn không khí
- Tan nhiều trong nước → dung dịch Ammonia có nồng độ 25%
b. Tìm hiểu tính chất hóa học của Ammonia
* Ammonia có tính khử và tính base:
- Ammonia tan trong nước tạo thành ion ammonium NH4+ và giải phóng ion OH-
NH3 + H2O ⇌ NH4+ + OH-
- Ammonia tác dụng với Acid (HCl, H2SO4) → muối ammonium
- Ammonia cháy trong khí oxy → nitrogen và hơi nước
- Khi có xúc tác Pt, ở nhiệt độ cao tạo thành NO và H2O
3. Tổng hợp Ammonia
Vận dụng kiến thức hóa học cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber
- Các bước của quá trình Haber:
+ Trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp, hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1:3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia
+ Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh:
+ NH3 được hóa lỏng
+ Hỗn hợp khí N, và H, chưa phản ứng được đưa trở lại tháp tổng hợp.
Ví dụ: N2(g) + 3H2(g) ⇌ 2NH3(g)
4. Muối Ammonium
a. Tìm hiểu tính chất vật lí của Ammonium
- Muối ammonium được cấu tạo bởi cation ammonium
- Kí hiệu: NH4
+ Muối ammonium là những chất tinh thể ion
+ Dễ tan trong nước
b. Tìm hiểu tính chất hóa học của Ammonium
- Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khí ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
Ví dụ: NH4+ + OH- → NH3↑ + H2O
- Muối ammonium dễ bị phân huỷ khi đun nóng.
5. Ứng dụng
a. Tìm hiểu ứng dụng của ammonia
- Sử dụng để sản xuất nitric acid, các loại phân đạm
- Chất làm lạnh, làm dung môi và nhiều ứng dụng khác
b. Tìm hiểu ứng dụng của ammonium
- Ammonium nitrate dùng làm phân bón
- Ammonium khác dùng làm phân đạm, phân bón, phức hợp
Sơ đồ tư duy Ammonia và một số hợp chất ammonium
B. Trắc nghiệm Ammonia và một số hợp chất ammonium
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 3: Đơn chất nitrogen
Lý thuyết Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Bài 6: Sulfur và sulfur dioxide
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.