Toptailieu.vn xin giới thiệu Lý thuyết Một số hợp chất với oxygen của nitrogen (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết Một số hợp chất với oxygen của nitrogen (Chân trời sáng tạo) hay, chi tiết | Lý thuyết Hóa học 11
Bài giải Bài 5: Một số hợp chất với oxygen của nitrogen
A. Lý thuyết Một số hợp chất với oxygen của nitrogen
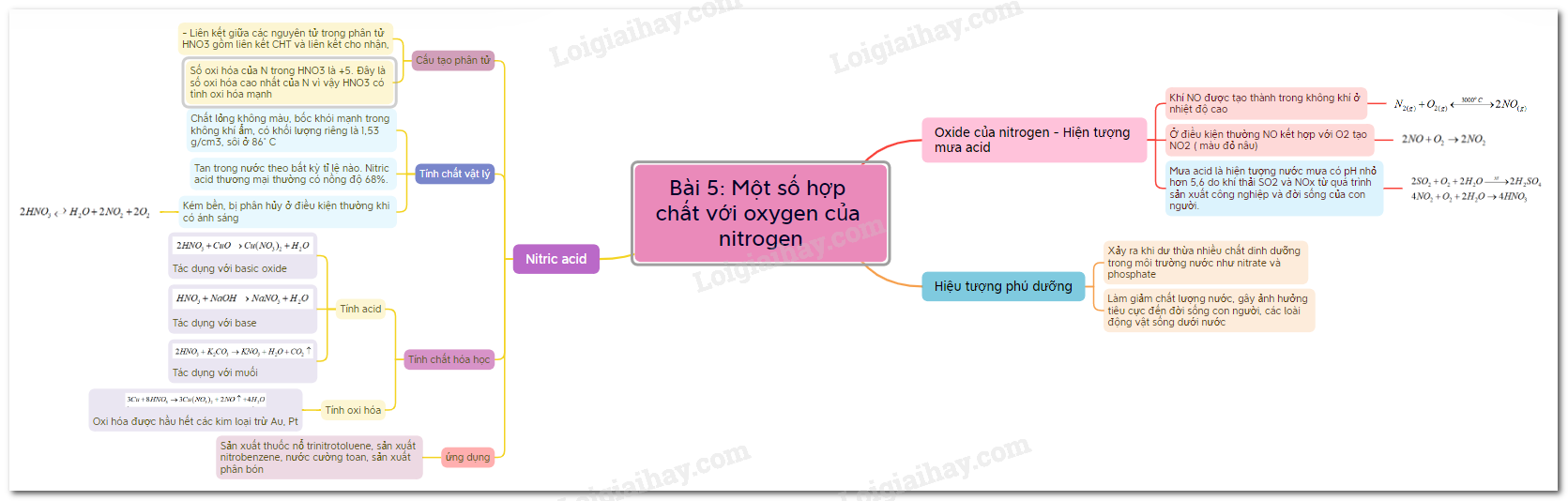
1. Các oxide của nitrogen – hiện tượng mưa acid
a) Nguồn gốc các oxide của nitrogen trong không khí
- Khí NO được tạo thành trong không khí ở nhiệt độ cao.
![]()
- Ở điều kiện thường, khí NO không màu kết hợp với oxygen trong không khí tạo khí NO2 màu nâu đỏ.
2NO+O2→2NO2
- Nitrogen oxide được hình thành từ những hiện tượng tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao. Các khí này độc, gây ảnh hưởng đến sức khỏe con người.
b) Hiện tượng mưa acid
- Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6 do lượng khí thải SO2 và NOx từ các quá trình tiêu thụ than đá, dầu mỏ hoặc các nguyên liệu tự nhiên khác trong sản xuất, sinh hoạt của con người.
- Các khí này hòa tan trong nước tạo thành dung dịch H2SO4 và dung dịch HNO3.
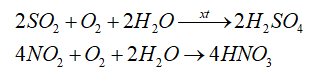
- Hiện tượng mưa acid gây ảnh hưởng đến đời sống con người, động – thực vật, môi trường, hủy hoại các công trình kiến trúc.
2. Nitric acid
a) Cấu tạo phân tử, tính chất vật lý
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 là liên kết cộng hóa trị và liên kết cho nhận.
- Số oxi hóa của N trong HNO3 là +5. Đây là số oxi hóa cao nhất của N, do đó trong các phản ứng oxi hóa – khử, HNO3 là chất oxi hóa.
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm3, sôi ở 86˚C.
- Nitric acid tan trong nước theo bất kỳ tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%.
- Nitric acid tinh khiết kém bền, bị phân hủy ngay ở điều kiện thường khi có ánh sáng.
2HNO3⇔H2O+2NO2+2O2
b) Tính chất hóa học và ứng dụng
- Nitric acid là một acid mạnh:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với basic oxide
2HNO3+CuO→Cu(NO3)2+H2O
+ Tác dụng với base
HNO3+NaOH→NaNO3+H2O
+ Tác dụng với muối của acid yếu hơn -> muối nitrate
2HNO3+K2CO3→KNO3+H2O+CO2↑
- Nitric acid là một trong ba acid chính của ngành công nghiệp hóa chất hiện đại và có tính ăn mòn kim loại.
- Nitric acid là một acid có tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại trừ vàng (Au), platium (Pt),…(một số kim loại như Al, Fe, Cr,… bị thụ động hóa trong dung dịch HNO3 đặc, nguội)
3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O
- Nitric acid có nhiều ứng dụng quan trọng trong đời sống và sản xuất: sản xuất thuốc nổ trinitrotoluene, sản xuất nitrobenzene, nước cường toan, sản xuất phân bón,…

3. Hiện tượng phú dưỡng
- Hiện tượng phú dưỡng xảy ra khi dư thừa nhiều chất dinh dưỡng trong môi trường nước như nitrate và phosphate.
- Hiện tượng này làm giảm chất lượng nước, làm ô nhiễm môi trường nước, gây ảnh hưởng tiêu cực đến đời sống con người cũng như các loài động vật sống dưới nước.
Sơ dồ tư duy Một số hợp chất với oxygen của nitrogen
B. Trắc nghiệm Một số hợp chất với oxygen của nitrogen
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Bài 6: Sulfur và sulfur dioxide
Lý thuyết Bài 7: Sulfuric acid và muối sulfate
Lý thuyết Bài 8: Hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.