Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Chân trời sáng tạo) Bài 5: Một số hợp chất với oxygen của nitrogen hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu SGK Hóa học 11 Bài 5 từ đó học tốt môn Hóa học 11.
Nội dung bài viết
Hoá học 11 (Chân trời sáng tạo) Bài 5: Một số hợp chất với oxygen của nitrogen
Giải Hóa 11 trang 30
Lời giải:
Nitrogen có thể tạo thành với oxygen các hợp chất NO, NO2, N2O, N2O3, N2O5.
+ Khí nitrogen monoxide (NO) được tạo thành trong không khí ở nhiệt độ cao.
N2(g) + O2(g) 2NO(g)
Ở điều kiện thường, khí NO không màu kết hợp với oxygen trong không khí tạo thành khí nitrogen dioxide (NO2) màu nâu đỏ.
2NO + O2 → 2NO2.
+ Các chất N2O, N2O3, N2O5 không điều chế được trực tiếp từ phản ứng giữa nitrogen và oxygen.
1. Các oxide của nitrogen - hiện tượng mưa acid
Lời giải:
Nguồn tạo ra khí NO, NO2 trong không khí:
+ Trong tự nhiên: Hiện tượng sấm sét.
+ Trong đời sống: Hoạt động của các phương tiện giao thông vận tải, nhà máy nhiệt điện, luyện kim, đốt nhiên liệu …
Giải Hóa 11 trang 31
Câu hỏi thảo luận 2 trang 31 Hóa học 11: Quan sát Hình 5.2, mô tả quá trình hình thành mưa acid.
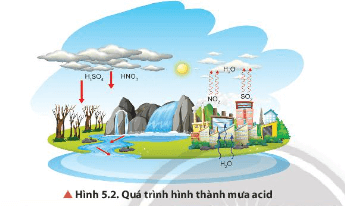
Lời giải:
Quá trình hình thành mưa acid:
+ Hoạt động của núi lửa, cháy rừng, sấm sét hoặc do con người tiêu thụ các nhiên liệu như than đá, dầu mỏ … làm phát sinh ra nhiều khí SO2, NOx (các khí oxide của nitrogen).
+ Dưới xúc tác của các ion kim loại trong khói bụi SO2, NOx bị oxi hoá, sau đó hoà tan trong nước mưa rơi xuống mặt đất, ao hồ … tạo thành hiện tượng mưa acid.
2SO2 + O2 + 2H2O 2H2SO4
4NO2 + O2 + 2H2O → 4HNO3.
N2 → NO → NO2 → HNO3
Lời giải:
Các phương trình hoá học minh hoạ chuỗi phản ứng:
N2(g) + O2(g) 2NO(g)
2NO(g) + O2(g) → 2NO2(g)
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq).
Câu hỏi thảo luận 4 trang 31 Hóa học 11: Quan sát Hình 5.3, hãy nêu một số tác hại của mưa acid.

Lời giải:
Một số tác hại của mưa acid: làm thay đổi thành phần của nước sông, hồ, gây hại cho động vật sống dưới nước và các sinh vật khác, huỷ hoại các công trình xây dựng, kiến trúc, cảnh quan thiên nhiên …
2. Nitric acid
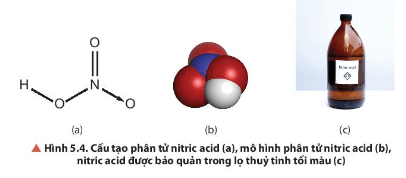
Lời giải:
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 thuộc loại liên kết cộng hoá trị.
- Trong HNO3, nitrogen có số oxi hoá là +5, đây là số oxi hoá cao nhất của nitrogen.
- Dự đoán: Trong phản ứng oxi hoá – khử nitrogen đóng vai trò là chất oxi hoá.
Giải Hóa 11 trang 32
Câu hỏi thảo luận 6 trang 32 Hóa học 11: Tại sao phải bảo quản nitric acid trong các lọ tối màu?
Lời giải:
Nitric acid tinh khiết kém bền, bị phân huỷ một phần giải phóng khí nitrogen dioxide (NO2) ngay ở điều kiện thường khi có ánh sáng. Do đó, cần bảo quản nitric acid trong các lọ tối màu.
Lời giải:
Một số ứng dụng của HNO3 trong đời sống và sản xuất:
- Sản xuất thuốc nổ;
- Sản xuất phân bón;
- Sản xuất thuốc nhuộm vải…
Lời giải:
Các phương trình hoá học:
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + CO2↑ + H2O.
Các phản ứng này không phải là phản ứng oxi hoá – khử; do không có sự thay đổi số oxi hoá của các nguyên tố trước và sau phản ứng.
3. Hiện tượng phú dưỡng
Giải Hóa 11 trang 33
Câu hỏi thảo luận 8 trang 33 Hóa học 11: Hãy cho biết dấu hiệu nhận biết hiện tượng phú dưỡng.
Lời giải:
Dấu hiệu nhận biết ao, hồ có hiện tượng phú dưỡng: xuất hiện dày đặc tảo xanh trong nước; nguồn thuỷ sản trong ao hồ bị suy kiệt; xuất hiện mùi hôi thối khó chịu.

Câu hỏi thảo luận 9 trang 33 Hóa học 11: Hãy nêu một số phương pháp hạn chế hiện tượng phú dưỡng.
Lời giải:
Một số phương pháp hạn chế hiện tượng phú dưỡng:
- Xử lí nước thải trước khi đổ vào ao hồ.
- Trồng một số thực vật thuỷ sinh phù hợp với môi trường phú dưỡng: bèo tây, ngổ trâu, cải xoong … Trồng thực vật thủy sinh cũng sẽ làm giảm mức độ dinh dưỡng trong nước ao, hồ và do đó không khuyến khích sự nhân lên của thực vật phù du.
- Sử dụng chế phẩm vi sinh để tăng vi sinh có lợi.
- Tảo phát triển mạnh trong nước thiếu oxygen. Do đó tăng cường oxygen ngay lập tức bằng việc lắp đặt thiết bị sục khí để khuấy trộn bề mặt ao và giúp giải phóng các loại khí như CO2. Điều này cũng cho phép nước hấp thụ nhiều oxygen hơn, trong thời gian ngắn sẽ giúp giảm sự hiện diện của tảo.
Lời giải:
Nước thải chăn nuôi chứa nhiều các nguyên tố dinh dưỡng như nitrogen, phosphorus … Khi thải trực tiếp nước thải chăn nuôi xuống ao, hồ, các dưỡng chất này không được tiêu thụ hết sẽ gây ra tình trạng dư, thừa, dẫn đến hiện tượng phú dưỡng.
Giải Hóa 11 trang 34
Bài tập (trang 34)
NH3 NO
NO2
HNO3
a) Viết các phương trình hoá học xảy ra.
b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của phản ứng sản xuất nitric acid theo sơ đồ trên là 96,2%.
Lời giải:
a) Các phương trình hoá học xảy ra:
4NH3 + 5O2 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
b) Khối lượng nitric acid có trong 200 000 tấn dung dịch nitric acid 60% là:
(tấn).
Sơ đồ: NH3 NO
NO2
HNO3
1 1 mol
17 63 gam
m 120 000 tấn
Hiệu suất của phản ứng sản xuất nitric acid là 96,2%, thì khối lượng ammonia cần dùng là:
(tấn).
Lời giải:
Trường hợp gây ra hiện tượng phú dưỡng: nước thải, phân bón hoá học chưa xử lí thải trực tiếp vào ao, hồ.
Giải thích: Nước thải, phân bón hoá học chứa nhiều các nguyên tố dinh dưỡng như nitrogen, phosphorus … Khi thải trực tiếp xuống ao, hồ, các dưỡng chất này không được tiêu thụ hết sẽ gây ra tình trạng dư, thừa, dẫn đến hiện tượng phú dưỡng.
Lời giải:
Dưới xúc tác của các ion kim loại trong khói bụi.. NO2 bị oxi hoá, sau đó hoà tan trong nước mưa rơi xuống mặt đất, ao hồ … tạo thành hiện tượng mưa acid.
4NO2 + O2 + 2H2O → 4HNO3
Trong HNO3 có chứa nitrogen cũng góp phần gây nên hiện tượng phú dưỡng.
Xem thêm các bài giải SGK Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.