Toptailieu.vn xin giới thiệu Lý thuyết KHTN 8 (Cánh diều) Bài 12: Muối. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết KHTN 8 (Cánh diều) Bài 12: Muối
Bài giảng Bài 12: Muối
A. Kiến thức trọng tâm KHTN 8 Bài 12: Muối
I. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: NaCl, K2SO4, Ca3(PO4)2, NH4NO3 …
II. Tên gọi của muối
Tên gọi muối của một số acid được trình bày trong bảng sau:
|
Acid |
Muối |
Ví dụ |
|
Hydrochloric acid (HCl) |
Muối chloride |
Sodium chloride: NaCl |
|
Sulfuric acid (H2SO4) |
Muối sulfate |
Copper(II) sulfate: CuSO4 |
|
Phosphoric acid (H3PO4) |
Muối phosphate |
Potassium phosphate: K3PO4 |
|
Carbonic acid (H2CO3) |
Muối carbonate |
Calcium carbonate: CaCO3 |
|
Nitric acid (HNO3) |
Muối nitrate |
Magnesium nitrate: Mg(NO3)2 |
III. Tính tan của muối
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, …
- Có muối ít tan trong nước như: CaSO4, PbCl2, …
- Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, …
- Tính tan của một số muối được trình bày trong bảng tính tan sau:
Bảng tính tan trong nước của một số muối
|
Gốc acid |
Các kim loại |
|||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
|
− Cl |
t |
t |
k |
t |
t |
t |
t |
i |
t |
t |
t |
t |
|
− NO3 |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
|
= SO4 |
t |
t |
i |
t |
i |
k |
t |
k |
t |
t |
t |
t |
|
= CO3 |
t |
t |
k |
k |
k |
k |
k |
k |
- |
k |
- |
- |
|
≡ PO4 |
t |
t |
k |
k |
k |
k |
k |
k |
k |
k |
k |
k |
t: chất dễ tan trong nước
k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
(-): chất không tồn tại hoặc bị nước phân huỷ.
IV. Tính chất hoá học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Fe(NO3)2 + Cu → Cu(NO3)2 + Fe
2. Tác dụng với acid
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Ví dụ:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với base
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
4. Tác dụng với muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
V. Mối quan hệ giữa acid, base, oxide và muối
Mối quan hệ giữa acid, base, oxide và muối được tóm tắt trong sơ đồ sau:
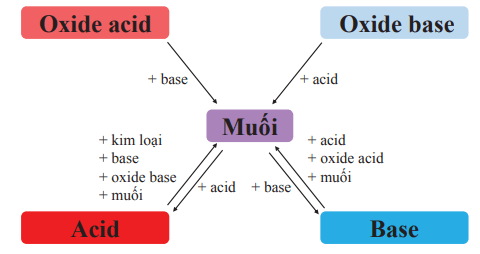
Muối có thể được tạo ra bằng các phương pháp sau:
- Cho dung dịch acid tác dụng với base. Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
- Cho dung dịch acid tác dụng với oxide base. Ví dụ:
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
- Cho dung dịch acid tác dụng với muối. Ví dụ:
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- Cho dung dịch base tác dụng với oxide acid. Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
- Cho hai dung dịch muối tác dụng với nhau. Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
B. Bài tập KHTN 8 Bài 12: Muối
Đang cập nhật
Xem thêm các bài lý thuyết Khoa học tự nhiên 8 Cánh diều hay, chi tiết khác:
Bài mở đầu: Làm quen với bộ dụng cụ, thiết bị thực hành môn KHTN 8
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.